铬及其化合物常被应用于冶金、化工、电镀、制药、纺织等行业,但使用后的废水因其中含高价铬的化合物而毒性很强。工业上往往采取下列循环工艺防止铬的污染: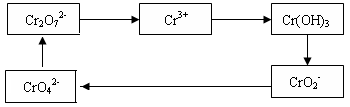
完成下列填空:
(1)含Cr2O72-离子的废水在酸性条件下用Fe3O4处理,反应的离子方程式如下:
Cr2O72- + Fe3O4 + H+ → Cr3+ + Fe3+ + H2O
配平上述离子反应方程式,并标出反应中电子转移的方向和数目。
(2)向上述反应后的溶液中加入碱溶液,让废水的pH升至8~10,控制适当的温度,使产物中的金属阳离子全部转变为沉淀。写出从该沉淀中分离出Cr(OH)3的离子方程式 、
。
(3)回收所得的Cr(OH)3,经处理后又可转变成K2Cr2O7。纯净的K2Cr2O7常用于准确测定Na2S2O3溶液的物质的量浓度,方法如下:
① Cr2O72- +6I- + 14H+ →3I2 + 2Cr3+ + 7H2O ② 2S2O32- + I2→S4O62- + 2I-
准确称取纯净的K2Cr2O7 0.1225g ,配成溶液,用Na2S2O3溶液滴定,消耗Na2S2O3溶液25.00mL。则Na2S2O3溶液的物质的量浓度为 (保留四位有效数字)。
按所示格式填写下表有序号的表格:
| 原子序数 |
电子排布式 |
价层电子排布 |
周期 |
族 |
所在分区 |
| 17 |
|||||
| 1s22s22p6 |
|||||
| 3d54s1 |
|||||
| 29 |
|||||
| 8 |
配平并完成方程式。
(1) Pt+ HNO3+ HCl H2PtCl6+ NO↑+ ( )
H2PtCl6+ NO↑+ ( )
(2)Fe+ HNO3(稀) Fe(NO3)3+ NO↑+ H2O被还原与未被还原的氮元素质量之比。
Fe(NO3)3+ NO↑+ H2O被还原与未被还原的氮元素质量之比。
(3)Cu2S+ HNO3 Cu(NO3)2+ NO↑+ S↓+ H2O
Cu(NO3)2+ NO↑+ S↓+ H2O
被还原与未被还原硝酸物质的量之比是被还原的元素是。
氯水的成分及探究
①新制氯水呈____色,或氯水能使淀粉碘化钾试纸变蓝,都可以说明___ ____存在
②氯水的PH值_____水,说明氯水呈____性
③向氯水中滴加紫色石蕊试液产生的现象是_________,可以说明氯水中存在______微粒
④在氯水中加入AgNO3溶液,产生的现象_________说明存在_______微粒
⑤可以用钢瓶来存在液氯,为了防止钢瓶的腐蚀,冲入氯气前必须_____
⑥在氯水中加入无水CuSO4固体,产生的现象_________说明存在______微粒
实验室需要0.1 mol·L-1NaOH溶液450mL,根据溶液配制情况回答下列问题:
(1)实验中除了托盘天平、烧杯、500mL容量瓶外还需要的其它仪器有:
(2)根据计算得知,所需NaOH的质量为g。
(3)如果出现以下操作,能使所配浓度偏大的是(填写字母)
| A.称量用了生锈的砝码; | B.将NaOH放在纸张上称量 |
| C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中 | |
| D.往容量瓶转移时,有少量液体溅出 |
E.未洗涤溶解NaOH的烧杯 F.定容时仰视刻度线
G.容量瓶未干燥即用来配制溶液H.定容后塞上瓶塞颠倒摇匀,正立静置后,液面不到刻度线,再加水至刻度线。
下列仪器中:①漏斗②容量瓶③蒸馏烧瓶④天平⑤分液漏斗⑥滴定管⑦燃烧匙,常用于物质分离的是,其中根据物质沸点不同分离物质的仪器是;在使用前需要查漏的仪器(填序号)