某校化学小组的同学进行以碳棒为电极电解氯化铜溶液时发现阴极碳棒上除了有红色物质析出外,还有少量白色物质析出。为探究阴极碳棒上的产物,设计了如下过程:
Ⅰ、有关资料
铜的化合物颜色性质如下:
| 物质 |
颜色、性质 |
物质 |
颜色、性质 |
| 氢氧化铜Cu(OH)2 |
蓝色固体不溶于水 |
硫酸铜(CuSO4) |
溶液呈蓝色 |
| 氧化亚铜(CuO) |
红色固体不溶于水 |
氯化铜(CuCl2) |
溶液呈绿色,稀溶液呈蓝色 |
| 氯化亚铜(CuCl) |
白色固体不溶于水 |
碱式氯化铜 |
绿色固体不溶于水 |
Ⅱ、探究实验
(1)提出假设:①红色物质一定有铜,还可能有Cu2O;②白色物质为铜的化合物,其化学式可能为CuCl
(2)实验验证:取电解CuCl2溶液后的阴极碳棒,洗涤、干燥,连接下列装置进行实验,验证阴极产物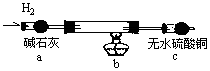
实验结束后,碳棒上的白色物质变为红色,无水硫酸铜不变色。
①碳棒上的红色物质是否有Cu2O (填“是”或“否”),理由是
;②在c装置后将气体通入 中,若出现白色沉淀,可说明提出假设②中的白色物质一定存在;③写出装置b中发生反应的化学方程式:
。
(3)问题讨论:
①电解CuCl2溶液后的阴极上发生的反应为:Cu2++2e-=Cu和 ;②用石墨电极电解饱和硫酸铜溶液,观察阴极碳棒表面出现的现象红色物质附着,无白色物质,加入 后继续电解,出现白色物质。
化学实验要符合“绿色化学”理念。某实验小组对“铜与浓硝酸反应”进行了探究性实验。试回答下列问题: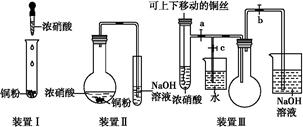
(1)写出铜和浓硝酸反应的离子方程式:。
(2)与装置Ⅰ相比,装置Ⅱ的优点是,装置Ⅲ除具有装置Ⅱ的优点外,还有的优点是。
(3)在装置Ⅲ中,若使NO2气体充满烧瓶,应先关闭弹簧夹 ,再打开弹簧夹 ;当气体充满烧瓶后,将铜丝提起,然后把a、b、c都关闭,并把烧瓶置于沸水中,下列情况不变的是 。
| A.颜色 |
| B.质量 |
| C.气体的平均相对分子质量 |
| D.密度 |
E.压强
(4)为了验证NO2与水的反应,欲使烧杯中的水进入烧瓶的操作是。
某化学研究性学习小组对硫酸铜分解气体产物的成分进行如下探究:
【查阅资料】
硫酸铜受热分解生成氧化铜和气体,温度不同时,气体可能为SO3,SO2和O2中的一种、两种或三种。
【提出假设】
假设1:气体产物只有一种;
假设2:气体产物只有两种;
假设3:气体产物有三种。
(1)若假设1成立,则产物气体的成分是 ;若假设2成立,则产物气体的成分是 。
【实验及结果讨论】
(2)甲同学将分解生成的气体依次通过盛浓硫酸和KMnO4酸性溶液的洗气瓶,能说明产物气体中含SO2的现象是 ,该现象说明SO2具有的性质是 ,实验中还发现盛浓硫酸的洗气瓶质量明显增加,原因是 。
(3)乙同学将分解生成的气体通过碱石灰后,再收集测定剩余气体的体积,在不同温度下进行3组实验。请完成下表(实验中硫酸铜均完全分解):
| 实验 序号 |
称取CuSO4 的质量/g |
碱石灰的 增加质量/g |
剩余气体的体积(折算 成标准状况下)/mL |
结论 |
| Ⅰ |
6.4 |
假设1成立 |
||
| Ⅱ |
6.4 |
2.88 |
224 |
|
| Ⅲ |
6.4 |
2.56 |
448 |
碘是人体必需的微量元素之一,有“智力元素”之称。食用加碘食盐可预防碘缺乏病。查阅资料知:
①在酸性条件下,I-能被N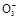 氧化成I
氧化成I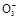 ,被H2O2或O2等氧化成I2;
,被H2O2或O2等氧化成I2;
②I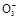 能被HS
能被HS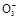 还原成I2。
还原成I2。
请你利用实验室常用仪器和下列限选试剂,依次研究某食盐样品中所加碘的存在形式是I2、I-、I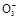 中的哪一种。
中的哪一种。
限选试剂如下:1.0 mol·L-1 HNO3溶液、1.0 mol·L-1 H2SO4溶液、1.0 mol·L-1 NaHSO3溶液、3% H2O2溶液、1%淀粉溶液、蒸馏水
Ⅰ.提出假设
假设1:该食盐样品中含I2;
假设2:该食盐样品中含I-;
假设3: 。
Ⅱ .设计方案与实验探究
将适量食盐样品溶于蒸馏水制成溶液,请按要求填写下表。
| 实验步骤 |
预期现象与结论 |
| 步骤1:取少量上述溶液注入试管中,滴入几滴淀粉溶液振荡 |
若溶液显 ,则假设1成立;否则,假设1不成立,再进行步骤2 |
| 步骤2: |
若溶液显蓝色,则假设2成立,反应的离子方程式为 ; 否则,假设2不成立,再进行步骤3 |
| 步骤3: |
Ⅲ.问题与思考
纯的KIO3或KI都可以作为食用加碘盐中碘的来源。从化学角度来看,食盐中添加 (填“KIO3”或“KI”)更好;理由是。
氯水是实验室常需临时配制的一种试剂,图甲所示的是实验室配制氯水时的一种常用装置,图乙是某化学实验小组自行设计的一种配制氯水的装置(图中的鼓气球是一种具有气体单向阀的、可用于向瓶中鼓入空气的仪器)。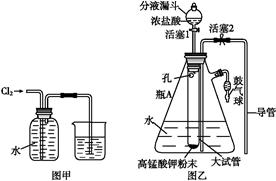
(1)氯水需临时配制的原因是: (用化学方程式表示)。
(2)图甲所示装置中,烧杯内的液体是 。
(3)图乙所示装置中,瓶A 内的大试管上端管壁钻有一个小孔,瓶A的名称叫 ,该仪器通常用于
实验中(填基本实验操作的名称)。
(4)用图乙所示装置配制氯水时,操作步骤如下:
①关闭活塞2,打开分液漏斗上口的玻璃塞,再打开活塞1,将少量浓盐酸注入大试管内。
②关闭活塞1,盖上分液漏斗上口玻璃塞。浓盐酸和大试管内的高锰酸钾粉末反应产生氯气。
③轻轻摇动瓶A,使氯气不断溶入水中。
用图乙装置能在较短时间内得到饱和氯水。除了在摇动过程中增大了气体和水的接触面以外,另一个重要原因是。
分液漏斗中的盐酸应分数次加入试管内。若一次加入太多的盐酸,可能引起的后果是。
(5)配制氯水完成后,不必拆卸装置即可从瓶A中取用少量氯水,方法是。
某化学小组在学习元素周期律后,对教材中Fe2+氧化为Fe3+的实验进一步思考,并提出问题:Cl2能将Fe2+氧化为Fe3+,那么Br2和I2能否将Fe2+氧化为Fe3+?
环节一:理论推测
部分同学认为Br2和I2都可能将Fe2+氧化为Fe3+,他们思考的依据是 。
部分同学认为Br2和I2都不能将Fe2+氧化为Fe3+,还有同学认为Br2能将Fe2+氧化为Fe3+而I2不能。他们思考的依据是从上到下卤素单质氧化性减弱。
环节二:设计实验进行验证
在大试管中加适量铁粉,加入10 mL稀盐酸,振荡试管,充分反应后,铁粉有剩余,取上层清液进行下列实验。
实验1:
| 试管 |
操作 |
现象 |
| ① |
先向试管中加入2 mL FeCl2溶液,再滴加少量红棕色的溴水,振荡试管 |
溶液为黄色 |
| ② |
先向试管中加入2 mL FeCl2溶液,再滴加少量棕黄色的碘水,振荡试管 |
溶液为黄色 |
环节三:实验现象的分析与解释
(1)同学甲认为①中现象说明溴水能将Fe2+氧化,离子方程式为 。
同学乙认为应该补充实验,才能得出同学甲的结论。请你帮助同学乙完成实验:
实验2:
| 操作 |
应该观察到的现象 |
(2)该小组同学对②中溶液呈黄色的原因展开了讨论:
可能1:碘水与FeCl2溶液不反应,黄色是碘水稀释后的颜色。
可能2: 。
实验3:进行实验以确定可能的原因。
| 操作 |
现象 |
| 向试管②所得溶液中继续加入0.5 mL CCl4,充分振荡,静置一段时间后。取出上层溶液,滴加KSCN溶液 |
静置后,上层溶液几乎无色,下层溶液为紫色;上层溶液滴加KSCN溶液后,出现浅红色 |
同学丙认为该实验现象可以说明是“可能2”成立,同学丁认为不严谨,于是设计了实验4:
实验4:
| 操作 |
现象 |
| 向另一支试管中加入2 mL FeCl2溶液,滴加0.5 mL碘水后,再加入0.5 mL乙酸乙酯,充分振荡,静置一段时间后。取出下层溶液,滴加KSCN溶液 |
静置后,上层液为紫色,下层液几乎无色;下层溶液滴加KSCN溶液后,没有出现浅红色 |
你认为实验4设计的主要目的是 。
同学丁根据实验4现象得出结论:在本次实验条件下,碘水与FeCl2溶液反应的程度很小。
(3)Cl2、Br2、I2氧化Fe2+的能力逐渐减弱,用原子结构解释原因:。