二甘醇又称乙二醇醚,分子式为C4H10O3(HO-CH2-CH2-O-CH2-CH2-OH),二甘醇是一种重要的化工原料,可以制取酸、酯、胺等,用途十分广泛。二甘醇一般的合成路线如下:

过程Ⅰ Br2 条件Ⅱ 反应Ⅲ
(1)过程Ⅰ是石油加工中常用步骤,其名称为 ;从物质B到物质C的反应条件Ⅱ是 ,该反应属于 (填写反应类型);物质B到物质C的过程如果条件控制不好会生成物质E,E可用于金属的切割,写出B可能生成E的化学方程式 。
(2)写出上述合成路线中的物质A、B、C的结构简式:
A ;B ;C
(3)反应Ⅲ的化学方程式为: 。
已知A、B、C、D、E、F六种有机物存在如下转化关系, E分子中有三种不同的氢原子,且其个数比为6:1:1,F能使Br2的CCl4溶液褪色。请回答下列问题: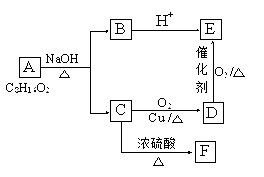
(1)C和E的官能团名称:C,E;
(2)由F生成高聚物的化学方程式。
(3)六种有机物中能跟Na反应的是(填字母)
(4)由A生成B和C的化学反应方程式为。
(5)D在一定条件下生成C的化学反应方程式为。
不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气。为了验证这一事实,某同学拟用下图装置进行实验(实验时压强为10lkPa,温度为0℃)。
(1)若在烧瓶中放入1.30g锌粒,与c mol/L H2SO4反应,为保证实验结论的可靠,量气管的适宜规格是_____________ 。
A.200 mL B.400 mL C.500mL
(2)若1.30g锌粒完全溶解,氢氧化钠洗气瓶增重l.28g ,则圆底烧瓶中发生反应的化学方程式为:_______________________________________。
(3)若烧瓶中投入a g锌且完全反应,氢氧化钠洗气瓶增重b g.量气瓶中收集到VmL气体,则有:ag/65g·mol-1=bg/64g·mol-1+V mL / 22400 mL·mol-1,依据的原理是____________________________。
(4)若在烧瓶中投入d g锌,加入一定量的c mol/L 浓硫酸V L,充分反 应后锌有剩余,测得氢氧化钠洗气瓶增重mg,则整个实验过程产生的气体中,n(H2)/n(SO2)=_______________(用含字母的代数式表示)。若撤走盛有无水氯化钙的U型管,n(H2)/n(SO2)的数值将
应后锌有剩余,测得氢氧化钠洗气瓶增重mg,则整个实验过程产生的气体中,n(H2)/n(SO2)=_______________(用含字母的代数式表示)。若撤走盛有无水氯化钙的U型管,n(H2)/n(SO2)的数值将
(填偏大、偏小或无影响)
(5) 反应结束后,为了准确地测量气体体积,量气管在读数时应注意:
①;
②;
③。
已知M为氮元素与一种金属元素组成的离子化合物,其中金属元素的质量分数为354%,M在汽车安全气囊中有重要的作用。常温下G为淡黄色固体。H为一种常见的液体,A、B、C、X为单质,其中A、C、X为气体,A、X均为空气中成分。I、J为常见的工业原料。
 ①写出D与X反应的化学方程式
①写出D与X反应的化学方程式 ②写出G与H反应的离子方程式。
②写出G与H反应的离子方程式。
③实验室中I应如何保存?。
④常温下M受撞击时可分解,13gM完全分解为A和B时,放出akJ的热量,写出M分解的热化学方程式。
⑤M是一种易溶于水的盐,其水溶液显弱碱性,用离子方程式解释原因。
现有四种短周期元素X、Y、Z、W,其中:①X、W原子的电子层数与最外层电子数之比分别为3:1和1:3②Y元素的某原子核内无中子③Z元素原子的最外层电子数是其内层电子总数的2倍。回答下列问题:
(1)X元素在周期表中的位置是。
(2)化合物X2W2的电子式是。
(3)向含1molNa2SiO3的溶液中缓慢通入2mol的ZO2,反应的离子方程式是。
(4)由Y、Z、W元素中的两种或三种可以组成多种分子,其中含有18个电子的分子是(只需填一个化学式)。
(5)用KMnO4溶液可以通过滴定来测定Y2Z2W4溶液的物质的量浓度。向2500mL的Y2Z2W4溶液中加入500mL050mol/L酸性KMnO4溶液恰好完全反应,得到ZO2和Mn2+,则此种Y2Z2W4溶液的物 质的量浓度是mol/L。
质的量浓度是mol/L。
[化学——选修有机化学基础]
环己烯常用于有机合成。现通过下列流程,以环己烯为原料合成环醚、聚酯、橡胶,其中F可以做内燃机的抗冻剂,J分子中无饱和碳原子。
已知:R1-CH=CH-R2  R1-CHO+R2-CHO
R1-CHO+R2-CHO
(1)F的名称是___________,C中含有的官能团的名称是______________。
(2)③的反应条件是_________________________。
(3)写出下列有机物的类别:A______________,E_______________。
(4)写出下列反应类型:⑥_________________,⑨______________。
(5)写出⑩反应的化学方程式:。
(6)有机物B和I的关系为____________(填序号,多填扣分)
| A.同系物 | B.同分异构体 | C.都属于醇类 | D.都属于烃 |