现有四种短周期元素X、Y、Z、W,其中:①X、W原子的电子层数与最外层电子数之比分别为3:1和1:3②Y元素的某原子核内无中子③Z元素原子的最外层电子数是其内层电子总数的2倍。回答下列问题:
(1)X元素在周期表中的位置是。
(2)化合物X2W2的电子式是。
(3)向含1molNa2SiO3的溶液中缓慢通入2mol的ZO2,反应的离子方程式是。
(4)由Y、Z、W元素中的两种或三种可以组成多种分子,其中含有18个电子的分子是(只需填一个化学式)。
(5)用KMnO4溶液可以通过滴定来测定Y2Z2W4溶液的物质的量浓度。向2500mL的Y2Z2W4溶液中加入500mL050mol/L酸性KMnO4溶液恰好完全反应,得到ZO2和Mn2+,则此种Y2Z2W4溶液的物 质的量浓度是mol/L。
质的量浓度是mol/L。
B是化学实验室中最常见的有机物,其产量可以用来衡量一个国家的石油化工发展水平,还是一种植物生长调节剂。并能进行如图所示的反应。且D能发生加聚反应。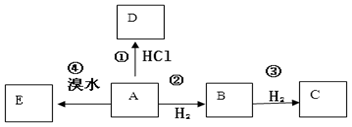
(1)写出A的结构简式
(2)下列反应的化学方程式和反应类型
反应②:;
(3)写出A与足量的溴水反应的方程式且命名产物:;
(4)写出D在一定条件下发生加聚反应的化学反应方程式:
某溶液中可能含有Cl-、SO42-、NO3-、CO32-等阴离子。
(1)、当溶液中有大量H+存在时,则上述阴离子在溶液中不可能大量存在的是。原因是(用离子方程式表示)。
(2)、当溶液中有大量Ba2+存在时,则上述阴离子在溶液中不可能大量存在的是。
按要求完成下列化学用语:
(1)NaHSO4的电离方程式:,
(2)CuSO4溶液和NaOH溶液反应的离子方程式:,
(3)能用H++OH-=H2O表示的一个化学方程式:。
(1)1mol H2O和1mol H2O2相比较,分子数之比为:
氧原子数之比为:;质量之比为:(最简单整数比)
(2)2mol H2SO4的质量为g,所含氧原子数目为。
选择下列实验方法分离物质,将分离方法的序号填在横线上:
| A.过滤 |
| B.结晶 |
| C.分液 |
| D.蒸馏 |
E.萃取分液
(1)分离水和植物油的混合物;
(2)分离饱和氯化钾溶液和沙子的混合物;
(3)从硝酸钾和氯化钠的混合溶液中获得硝酸钾;
(4)分离酒精(沸点为78.1℃)和甲苯(沸点为110.6℃)的混合物;
(5)将碘水中的碘单质与水分离。