第三主族的元素由于最外能层的p能级中有空轨道,故称为缺电子元素。
(1)已知气态氯化铝的化学式为Al2Cl6,写出Al2Cl6的结构式____________________;
(2)硼酸的结构式可表示为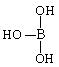 ,但硼酸溶于水后,1个硼酸分子与水作用,只能产生1个H+,请写出硼酸溶于水后溶液显酸性的离子方程式:(共4分)
,但硼酸溶于水后,1个硼酸分子与水作用,只能产生1个H+,请写出硼酸溶于水后溶液显酸性的离子方程式:(共4分)
不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如右图所示。试根据元素在周期表中的位置,分析图中吗线的变化特点,并回答下列问题。
(1)同主族内不同元素的E值变化的特点是:__________________________,各主族中E值的这种变化特点体现了元素性质的__________变化规律。
(2)同周期内,随原子序数增大,E值增大。但个别元素的E值出现反常现试预测下列关系式中正确的是______(填写编号,多选倒扣)
①E(砷)>E(硒)②E(砷)<E(硒)
③E(溴)>E(硒)④E(溴)<E(硒)
(3)估计1mol气态Ca原子失去最外层一个电子所需能量E值的范围:_____________<E<__________
(4)10号元素E值较大的原因是___________________
右表是元素周期表的一部分。(共7分)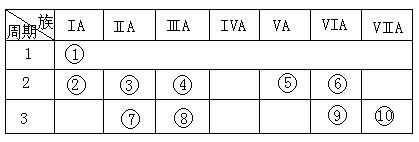
(1)表中元素⑩的氢化物的化学式为,此氢化物的还原性比元素⑨的氢化物的还原性(填强或弱)
(2)某元素原子的核外p电子数比s电子数少1,则该元素的元素符号是,其单质的电子式为。
(3)已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似的性质。写出元素③的氢氧化物与NaOH溶液反应的化学方程式
又如表中与元素⑦的性质相似的不同族元素是(填元素符号)
一种离子晶体的晶胞如右图。其中阳离子A以 表示,阴离子B以
表示,阴离子B以 表示。
表示。
(1)每个晶胞种含A离子的数目为________,含B离子数目为________。
(2)若A的核外电子排布与Ar相同,B的电子排布与Ne相同,则该离子化合物的化学式是___________________;
(3)阳离子的配位数为_________,阴离子的配位数为________。
(4)已知A的离子半径为0.99×10-10m,则该晶胞的体积是_______________m3。
(每空2分,共12分)
(每空1分,共12分)
H2O 分子构型,中心原子采取杂化,属于分子(填极性或非极性)
SO3 分子构型,中心原子采取杂化,属于分子(填极性或非极性)
HCN分子构型,中心原子采取杂化,属于分子(填极性或非极性)
CH4 构型,中心原子采取杂化,属于分子(填极性或非极性)