已知M为氮元素与一种金属元素组成的离子化合物,其中金属元素的质量分数为354%,M在汽车安全气囊中有重要的作用。常温下G为淡黄色固体。H为一种常见的液体,A、B、C、X为单质,其中A、C、X为气体,A、X均为空气中成分。I、J为常见的工业原料。
 ①写出D与X反应的化学方程式
①写出D与X反应的化学方程式 ②写出G与H反应的离子方程式。
②写出G与H反应的离子方程式。
③实验室中I应如何保存?。
④常温下M受撞击时可分解,13gM完全分解为A和B时,放出akJ的热量,写出M分解的热化学方程式。
⑤M是一种易溶于水的盐,其水溶液显弱碱性,用离子方程式解释原因。
(9分)
 某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表:(1)请从下表中实验现象(Ⅱ)(填A、B、C……)中选出与方案(I)(填1、2、3……)对应的实验现象,填入答案(Ⅲ)中。
某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表:(1)请从下表中实验现象(Ⅱ)(填A、B、C……)中选出与方案(I)(填1、2、3……)对应的实验现象,填入答案(Ⅲ)中。

| 实验方案(I) |
实验现象(Ⅱ) |
答案(III) |
|
| 实验方案I |
实验现象II |
||
1.用砂纸擦后的镁带与沸 水反应,再向反应液中滴 水反应,再向反应液中滴 加酚酞 加酚酞 |
A浮与水面,剧烈反应,放出气体, 熔成—个小球,在水面上无定向移 熔成—个小球,在水面上无定向移 动,随之消失,溶液变红色。 动,随之消失,溶液变红色。 |
1 |
|
2.向新制的H2S饱和溶 液中滴加新制的氯水 液中滴加新制的氯水 |
B.产生大量气体,可在空气中燃 烧,溶液变成浅红色 烧,溶液变成浅红色 |
2 |
|
3.钠与滴有酚酞的冷水反应 |
C.反应不十分剧烈,产生的气体 可以在空气中燃烧 可以在空气中燃烧 |
3 |
|
4.镁带与2mol/L的盐酸 反应 反应 |
D.剧烈反应,产生的气体可以在 空气中燃烧 空气中燃烧 |
4 |
|
5铝条与2mol/L的盐酸 反应 反应 |
E.生成白色絮状沉淀,继而沉淀 消失 消失 |
5 |
|
6.向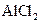 溶液中滴加 溶液中滴加 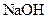 溶液至过量 溶液至过量 |
F.生成淡黄色沉淀 |
6 |
(2)通过以上实验分析了同周期元素的符号,从实验结果可以得出的结论是。
已知电极材料:铁、铜、银、石墨、锌、铝;电解质溶液: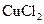 溶液、
溶液、 溶液、盐酸。按要求回答下列问题:
溶液、盐酸。按要求回答下列问题:
 (1)电工操作上规定:不能把铜导线和铝导线连接在一起使用。请说明原因
(1)电工操作上规定:不能把铜导线和铝导线连接在一起使用。请说明原因
 (2)若电极材料选铜和石墨,电解质溶液选硫酸铁溶液,外加导线,能否构成原电池
(2)若电极材料选铜和石墨,电解质溶液选硫酸铁溶液,外加导线,能否构成原电池 ,若能,请写出电极反应式,负极,正极。(若不能,后两空不填)
,若能,请写出电极反应式,负极,正极。(若不能,后两空不填)
 (3)设计一种以铁和硫酸反应为原理的原电池,要求画出装置图:(需标明电极材料及电池
(3)设计一种以铁和硫酸反应为原理的原电池,要求画出装置图:(需标明电极材料及电池 的正负。)
的正负。)
下列五种物质中,①Ar②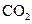 ③
③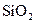 ⑤
⑤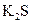 ,只存在共价键的是,只存在离子键的是,既存在离子键又存在共价键的是,不存在化学键的是。属于共价化合物的是属于离子化合物的是。
,只存在共价键的是,只存在离子键的是,既存在离子键又存在共价键的是,不存在化学键的是。属于共价化合物的是属于离子化合物的是。
下列反应中属于取代反应的是,属于加成反应的是。
①甲烷在光照下与氯气反应 ②乙烯使溴水褪色③乙烯使酸性高锰酸钾溶液褪色 ④苯与液溴反应 ⑤乙醇与乙酸酯化 ⑥苯与浓硝酸和浓硫酸的混酸反应
下面列出了几组物质,请将物质的合适序号填写在空格上。
互为同位素的是,互为同系物的是,互为同分异构体的是。
①金刚石与“足球烯”C60; ②D与T; ③16O、17O和18O;
④氧气(O2)与臭氧(O3); ⑤CH4和CH3CH2CH3;
⑥乙醇(CH3CH2OH)和甲醚(CH3OCH3);
|
CH3
⑦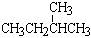 和 CH3-C-CH3
和 CH3-C-CH3
|