最近,各国科学家联合研制成功一种新型催化剂,可在常压下将二氧化碳与氢气混合转化为甲烷。在VL容器中进行该转化,相关情况如图所示。下列有关说法不正确的是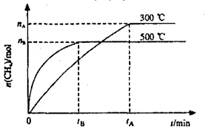
A.101KPa、120℃时,该反应的平衡常数表达式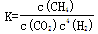 |
| B.断裂lmolC=O、2molH—H所吸收的能量小于形成2molC—H、2molO—H所释放的能量 |
C.300℃时,从反应开始达到平衡的这段时间,化学反应速率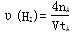 |
| D.其它条件不变,减小容器体积,二氧化碳的平衡转化率增大,平衡常数不变 |
下列各组离子能大量共存,向溶液中通入足量相应气体后,各离子还能大量存在的是
| A.氯气:K+ Ba2+ SiO32- NO3- | B.二氧化硫:Na+ NH4+ SO32- C1- |
| C.氨气:K+ Na+ AlO2-.CO32- | D.甲醛:Ca2+ Mg2+ MnO4- NO3- |
下列图示与对应的叙述相符的是 ( )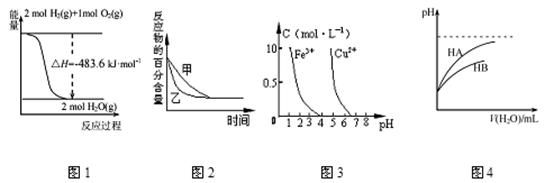
A.图1表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8 kJ·mol-1
B.图2表示压强对可逆反应2A(g)+2 B(g) 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
C.根据图3,若除去CuSO4溶液中的Fe3+,可向溶液中加入适量CuO,调节pH=4,过滤
D.图4表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则相同条件下NaA溶液的pH大于同浓度的NaB溶液的pH
化学方程式可简明地体现元素及其化合物的性质。已知:氧化还原反应:
2FeCl3 + 2HI = 2FeCl2 + I2 + 2HCl; 2Co(OH)3 + 6HCl = 2CoCl2 + Cl2↑ + 6H2O
2Fe(OH)2 + I2 + 2KOH= 2Fe(OH)3 + 2KI; 3I2 + 6KOH=" 5KI" + KIO3 + 3H2O
复分解反应:
2HSCN + K2CO3 =" 2KSCN" + CO2 ↑ + H2O; KCN + CO2 + H2O =" HCN" + KHCO3
热分解反应:4NaClO  3NaCl + NaClO4;NaClO4
3NaCl + NaClO4;NaClO4 NaCl + 2O2↑
NaCl + 2O2↑
下列说法正确是( )
| A.氧化性(酸性溶液):FeCl3 > Co(OH)3> I2 | B.还原性(碱性溶液):Fe(OH)2 > I2 > KIO3 |
| C.热稳定性:NaCl > NaClO > NaClO4 | D.酸性(水溶液):H2CO3 > HSCN > HCN |
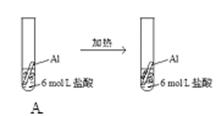
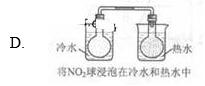
下列实验事实不能用平衡移动原理解释的是()
| c(醋酸) / (mol·L-1) |
0.1 |
0.01 |
| pH |
2.9 |
3.4 |


短周期元素X、Y、Z、W、R的化合价与原子序数的关系如右图所示。下列说法不正确的是( )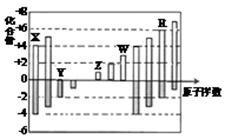
| A.原子半径:Z>W>Y |
| B.Z和Y形成的化合物是离子化合物 |
| C.气态氢化物的稳定性:R<Y |
| D.常温下单质W能溶于R的最高价氧化物对应水化物的浓溶液 |