甲、乙两个实验小组分别利用KMnO4酸性溶液与H2C2O4溶液反应进行研究外界因素对反应速率的影响。设计实验方案如下:
甲组:通过测定生成CO2气体体积的方法来比较化学反应速率的大小。
实验装置如图,实验时分液漏斗中A溶液一次性放入B溶液中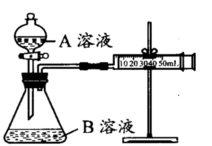
(注:实验中所用KMnO4溶液均已加人相同量H2SO4):
| 序号 |
A溶液 |
B溶液 |
| ① |
2 mL 0.1mol/LH2C2O4溶液 |
4 mL0.01mol/LKMnO4溶液 |
| ② |
2 mL 0.2mol/LH2C2O4溶液 |
4 mL0.01mol/LKMnO4溶液 |
(1)如何检查该装置的气密性: 。
(2)写出当锥形瓶中加入A溶液后发生的反应的离子方程式(提示:H2C2O4为弱酸): 。
(3)该实验探究的是 对化学反应速率的影响。分析所给实验仪器,实现该实验目的还欠缺的仪器: 。你将如何比较①②组化学反应速率大小?你的操作是 。
乙组:通过测定单位时间内KMnO4溶液浓度变化来判定反应速率快慢。
25℃时,40 mL 0.001mol/LKMnO4与38 mL0.1 mol/LH2C2O4和2 mL2.38mol/LH2SO4混合液共80 mL中KMnO4的浓度及对应时段的平均反应速率数据:
| 时间(min) |
4 |
8 |
12 |
16 |
21 |
22 |
23 |
24 |
25 |
| c(KMnO4)(10-4mol/L) |
4.58 |
4.02 |
3.36 |
2.25 |
0.72 |
0.43 |
0.23 |
0.16 |
0.13 |
| υ(KMnO4) (10-4mol/(L·min) |
υ |
0.14 |
0.17 |
0.28 |
0.32 |
0.29 |
0.20 |
0.07 |
0.03 |
(4)完成上表中υ= ×10-4mol/(L·min)。
问题讨论:已知该实验过程中溶液温度几乎不变,但是依据实验数据发现开始阶段速率却在增大。
①你认为引起该反应速率增大的因素是 。
②请设计实验证明你的观点,写出实验步骤及结论:
| 实验步骤及结论: |
X、Y、Z三种短周期元素,它们的原子序数之和为16 。X、Y、Z三种元素常见单质在常温下都是无色气体,在适当条件下可发生如下图所示变化:
已知一个B分子中含有的Z元素的原子个数比C分子中的少一个。
请回答下列问题:
(1)X元素在周期表中的位置是______________________。
(2)X的单质与Z的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则正极通入__________(填物质名称);负极电极反应式为____________________。
(3)C在一定条件下反应生成A的化学方程式是
。
某化学课外小组用如图装置制取溴苯并探
究该反应的类型。先向分液漏斗中加入苯和液溴,
再将混合液滴入反应器A(A下端活塞关闭)中。
(1)写出A中反应的化学方程式:_____________
___________________________。
(2)实验结束时,打开A下端的活塞,让反应
液流入B中,充分振荡,目的是 。
(3)C中盛放CCl4的作用是 。
(4)若要证明苯和液溴发生的是取代反应,而不是加成反应,通常有两种方法,请按要求填写下表。
| 向试管D中加入的试剂 |
能证明苯与液溴发生取代反应的现象 |
|
| 方法一 |
||
| 方法二 |
为研究硫酸的性质,研究性学习小组设计以下两个实验。实验一:检查好装置的气密性后,在如图一所示甲的试管中加入足量的Fe合金(含有一定量的C),然后,加入少量浓硫酸。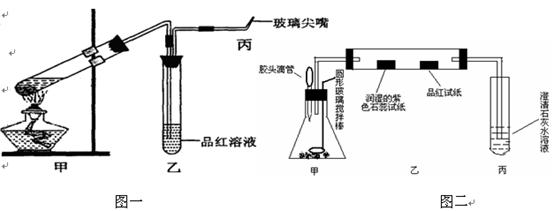
图一图二
①.在未点燃酒精灯时,乙中没有明显现象,这是因为________________________
为处理生成的有毒气体,还应在乙、丙之间接入干燥管,并在其中填充足量的。
②.反应开始一段时间后,在丙处检验到某种无色无味气体,它是__________。
若甲中加入的是纯铁,丙处产生气体的速率没有前者的快,这是因为____________
实验二:
高一必修教材《浓硫酸与蔗糖反应的实验》这个传统实验是在敞口容器中进行,药品用量大,且浓硫酸与蔗糖反应过程中生成大量有毒气体直接排放到空气中,不符合“绿色化学”的新理念;对此实验进行新的设计和改进:取少量的蔗糖置于锥形瓶中加入几滴水,用胶头滴管滴加几滴浓硫酸,通过圆形玻璃搅拌棒不断搅拌;如上图二所示观察:
①.白色的蔗糖发黄再变黑,这是因为浓硫酸具有性;一会儿迅速变成蜂窝状(形似“黑馒头” );写出发生的化学方程式:
②.紫色石蕊试纸变红,品红试纸褪色,澄清石灰水出现浑浊,该小组同学认为有二氧化碳生成,你是否赞成此观点;若赞成就不填写;若不赞成,你将如何改进才能证明有二氧化碳生成:
③.另一小组将紫色石蕊试纸更换为少许无水硫酸铜,结果没有观察到无水硫酸铜变蓝,证明浓硫酸具有;
某混合物X由A12O3、Fe2O3、Cu、SiO2中的一种或几种物质组成。进行如下实验。
请回答:
(1)由I可知X中一定存在的是 ,步骤I所发生反应的离子方程式为:、。
(2)反应II的化学方程式是。
为进一步确定上述混合物X的成分,另取9.4gX进行如下实验。
(3)由Ⅲ可得出的结论为:。
(4)步骤Ⅳ所得蓝色溶液中阳离子为。
(5)原混合物中各成分的质量之比是。(不必化简)
有机物A分子组成为C4H9Br,A中有一个支链,在一定条件下A可发生如下转化
|


