“类推”的思维方式在化学学习与研究中经常采用。下列类推思维中正确的是
| A.NaOH饱和溶液导电能力强,则Ca(OH)2饱和溶液导电能力也强 |
| B.CaC2能水解:CaC2+2H2O→Ca(OH)2+HC≡CH,则Mg2C2也能水解:Mg2C2+4H2O→2Mg(OH)2+CH3—C≡CH |
| C.加热时Cu与O2反应生成CuO,则加热时Cu与S反应生成CuS |
| D.BaCl2溶液中通入SO2无沉淀产生,则Ba(NO3)2溶液中通入SO2也无沉淀产生 |
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Z为地壳中含量最高的金属元素。下列说法正确的是
| X |
||||||
| Y |
Z |
W |
A.工业上电解ZW3饱和溶液冶炼金属Z
B.元素X的最高正价与W的最高正价相同
C.简单离子半径的大小顺序:r(Y+)>r(X—)
D.Y、W的最高价氧化物的水化物均能溶解金属Z
电浮选凝聚法处理污水的原理如图所示。电解过程生成的胶体能使污水中的悬浮物凝聚成团而除去,电解时阳极也会产生少量气体。下列说法正确的是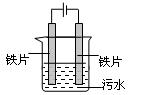
| A.阳极可以用碳棒代替铁片 |
| B.阳极产生的气体可能是H2 |
| C.电解过程中H+向阳极移动 |
| D.若污水导电能力较弱,可以加入适量硫酸钠 |
下列表示对应化学反应的离子方程式正确的是
| A.过量氨水中通入SO2:SO2+NH3·H2O===NH4++HSO3- |
| B.醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+=Ca2++CO2↑+H2O |
| C.Cu与浓硝酸反应:Cu+4HNO3(浓)=Cu2++2NO3-+2NO2↑+2H2O |
D.向新制Cu(OH)2中加入乙醛溶液并加热:CH3CHO+2Cu(OH)2+OH-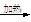 CH3COO-+Cu2O↓+3H2O CH3COO-+Cu2O↓+3H2O |
设NA为阿伏加德罗常数的值。下列说法正确的是
| A.标准状况下,2.24 L H2O中O原子的数目为0.1 NA |
B.0.1 mol羟基( )中含有的电子数为0.9 NA )中含有的电子数为0.9 NA |
| C.0.1 mol·L-1的FeCl3溶液中含有Fe3+的数目小于0.1 NA |
| D.0.1 mol SO2与足量O2反应,转移的电子数为0.2 NA |
甲、乙、丙、丁四种物质,甲、乙、丙含同一种元素。下列各组物质可按下图转化的是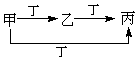
| ① |
② |
③ |
④ |
|
| 甲 |
CH4 |
S |
AlCl3 |
Fe |
| 丙 |
CO2 |
SO3 |
NaAlO2 |
FeCl3 |
A.①② B.②③ C.①③ D.③④