A、B、C、D、E是元素周期表中前四周期中五种常见元素,其相关信息如下表:
| 元素 |
相关信息 |
| A |
原子核外L层电子数是K层的2倍 |
| B |
其一种单质被称为地球生物的“保护伞” |
| C |
原子的第一电离能在第三周期中最小 |
| D |
基态原子最外层电子排布为(n+1)sn (n+1)p(n+2) |
| E |
可形成多种氧化物,其中一种为具有磁性的黑色晶体 |
请回答下列问题:
(1)C在元素周期表中位于第 周期、第 族;E的基态原子核外电子排布式是
(2)B、C、D的简单离子半径由大到小的顺序为(用化学符号表示,下同) ,B、D的简单气态氢化物中稳定性较大的是
(3)B、C的单质按物质的量比1:2形成的化合物中化学键的类型为 ;该化合物属于 晶体。
(4)E的黑色磁性晶体发生铝热反应的化学方程式是
(5)处理含AO、DO2烟道气污染的一种方法是将其在催化剂作用下转化为单质D。
已知:2AO(g)+ O2(g) =2AO2(g) ΔH="-566.0" kJ•mol-1
D(s)+ O2(g) = DO2(g) ΔH="-296.0" kJ•mol-1
此反应的热化学方程式是 。
(1)按要求写出下列各类具体反应的例子:
①两种弱酸相互反应生成两种强酸:。
②两种弱酸盐相互反应生成两种强酸盐:。
③两种酸溶液相互反应后溶液酸性减弱:。
④一种酸与一种盐溶液反应后溶液酸性增强。。
(2)广西盛产重晶石矿,其主要成分是;以BaSO4为原料通过如下反应可制得BaS:
BaSO4+4C  BaS+4CO↑
BaS+4CO↑
①上述反应中,元素被氧化,是氧化剂。
②BaS与盐酸反应可制得BaCl2,在此过程中会产生污染环境的物质,消除污染的方法是,有关的化学反应方程式是。
一烧杯中盛有100mL2mol·L-1的H2SO4溶液,有一表面光滑的塑料小球悬浮于溶液中央(如下图所示),向该烧杯里缓缓注入0.4mol·L-1的Ba(OH)2溶液至恰好完全反应,在此实验过程中: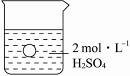
(1)烧杯里观察到的实验现象有:
① 。
② 。
(2)写出实验过程中反应的离子方程式: 。
X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条件:
①元素周期表中,Z与Y相邻,Z与W相邻;
②Y、Z和W三种元素的原子最外层电子数之和为17。
请填空:
(1)Y、Z和W三种元素是否位于同一周期(填“是”或“否”):_____________,理由是____________________________________________________。
(2)Y是_____________,Z是_____________,W是_____________。
(3)X、Y、Z和W可组成一化合物,其原子个数之比为8∶2∶4∶1。写出该化合物的名称及化学式__________________________。
A、B、C、D、E五瓶透明溶液,分别是HCl、BaCl2、NaHSO4、Na2CO3、AgNO3中的一种。
①A与B反应有气体生成②B与C反应有沉淀生成③C与D反应有沉淀生成④D与E反应有沉淀生成⑤A与E反应有气体生成⑥在②和③的反应中生成的沉淀是同一种物质
请填空:
(1)在②和③的反应中,生成沉淀的物质的化学式(分子式)是______________________。
(2)A是____________,B是____________,C是____________,D是____________,E是____________。
(3)A与E反应的离子方程式是_______________________________________________。
A、B、C三种常见短周期元素,可以形成AB2、C2B、C2B2、C2A、AB3等化合物。已知B的离子和C的离子有相同的电子层结构,A离子比B离子多一个电子层。完成下列问题。
(1)写出C2B2的电子式________________。
(2)AB3在常温下为________态,其固体属________晶体,AB3的水化物,在低温下和C2B2反应生成一种正盐和一种稳定性较差的过氧化物,写出反应的化学方程式________________。
(3)C2A属于________晶体,其水溶液呈________性,用离子方程式说明理由_____________。
(4)AB3在水化物跟C2A溶液反应的离子方程式为________________,此生成物与AB2反应的化学方程式为________________。