在烧杯里加入20 mL 0.1 mol/L的Ba(OH)2溶液,再滴几滴酚酞试液,然后用滴定管向烧杯中滴加等物质的量浓度的NaHSO4溶液。实验装置如下图(夹持仪器已去掉):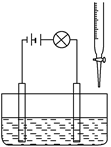
实验现象如下:
①灯泡逐渐变暗;
②烧杯中有白色沉淀生成,溶液红色变浅甚至消失。
请依据实验现象回答下列问题:
(1)灯泡变暗的原因是 。
(2)有白色沉淀生成,说明 ,
红色变浅说明 。
(3)当Ba2+恰好完全沉淀时,消耗NaHSO4溶液的体积为______ mL,离子反应方程式为 。
(4)若向(3)得到的溶液中,继续滴加NaHSO4溶液到恰好变为无色,此阶段的离子反应方程式为 。
镭是元素周期表中第ⅡA族元素,下列关于镭的叙述不正确的是()
| A.镭比钙的金属性更强 | B.在化合物中呈+2价 |
| C.镭是一种放射性元素 | D.氢氧化镭呈两性 |
一定温度下将amolPCl5通入一个容积不变的反应器中,达到如下平衡:PCl5 PCl3+Cl2测得压强为P1,此时向反应器中再通入amolPCl5,在温度不变的情况下再度达到平衡,测得压强为P2。则P1和P2的关系是()
PCl3+Cl2测得压强为P1,此时向反应器中再通入amolPCl5,在温度不变的情况下再度达到平衡,测得压强为P2。则P1和P2的关系是()
| A.2P1>P2 | B.2P1=P2 | C.2P1<P2 | D.无法判断 |
右图两个装置中,溶液体积均为200mL,开始时,电解质溶液的浓度均为0.1mol/L,工作一段时 间后,测得导线上都通过了0.02mol e一,若不考虑溶液体积的变化,则下列叙述正确的是()
间后,测得导线上都通过了0.02mol e一,若不考虑溶液体积的变化,则下列叙述正确的是()
| A.在①中Cu棒为阳极;在②中Cu棒为负极 |
| B.电极上析出物质的质量:①<② |
| C.电极反应式:①中阳极:4OH一一4e一= 2H2O+O2↑ ②中负极:2H+ + 2e一= H2↑ |
| D.溶液的pH:①不变;②增大 |
据环保部门测定,我国一些大城市的酸雨pH=3.5。在酸雨季节铁制品极易腐蚀,则在其腐蚀中正极主要发生的反应是( )
| A.2H++2e-=H2↑ | B.2H20+02+4e-=40H- |
| C.Fe-2e-=Fe2+ | D.40H--4e-=2H20+02↑ |
用铂电极电解CuSO4溶液,当c(Cu2+)降至原来的一半时停止通电,则加入下面物质能使溶液恢复成原来浓度的是()
| A.无水CuSO4 | B.CuO | C.Cu(OH)2 | D.CuSO4·5H2O |