海水是丰富的资源宝库,从海水中提取元素是化学工业的重要组成部分。
(1)粗盐精制就是除去其中的Ca2+、Fe3+、SO42-及泥沙等杂质,需加入的试剂有:①Na2CO3溶液 ②HCl(盐酸) ③Ba(OH)2溶液,这三种试剂的添加顺序是_________(填序号)。
(2)用氯气进行“海水提溴”中制取溴单质反应的离子方程式为:__________。
(3)某同学设计了如图装置进行以下电化学实验。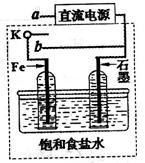
①当开关K与a连接时,两极均有气泡产生,则阴极为_______极。
②一段时间后,使开关K与a断开、与b连接时,虚线框内的装置可称为__________。请写出此时Fe电极上的电极反应式_________________。
(4)某公厂向盛有CaSO4悬浊液的反应池中通入氨气欲制取氮肥(NH4)2SO4,效果不好。再通入CO2,则逐渐产生大量(NH4)2SO4。请分析其原因 。
。
A~J均为有机化合物,它们之间的转化如下图所示: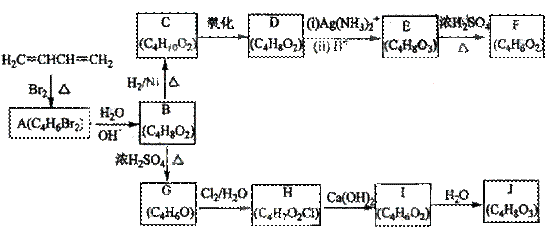
实验表明:
①D既能发生银镜反应,又能与金属钠反应放出氢气;
②核磁共振氢谱表明F分子中有三种氢,且其峰面积之比为1:1:1;
③G能使溴的四氯化碳溶液褪色;
④1mol J与足量金属钠反应可放出22.4L氢气(标准状况)。
请根据以上信息回答下列问题:
(1)A的结构简式为____________(不考虑立体结构),由A生成B的反应类型是____________反应;D的结构简式为_____________;
(2)由E生成F的化学方程式为_______________,E中官能团有_________(填名称),与E具有相同官能团的E的同分异构体还有________________(写出结构简式,不考虑立体结构);
(3)G的结构简式为_____________________;
(4)由I生成J的化学方程式______________。
已知:

(式中X代表卤素原子)有以下反应,最终产物是乙二酸。
试 回答下列问题:
回答下列问题:
(1)C的结构简式是;
(2)B→C的反应类型是;
(3)E→F的化学方程式是;
(4)写出E与乙二酸发生酯化反应生成环状化合物的化学方程式 ;
;
(5)写出E与乙二酸反应生成高分子化合物的化学方程式
;
(6)由B发生水解反应或C发生水化反应均生成化合物G。在乙二酸、水、苯酚、G四种分子中,羟基上氢原子的活泼性由强到弱的顺序是 。
。
已知苯氯乙酮的结构简式为 ,与苯氯
,与苯氯 乙酮互为同分异构体,分子中无甲基,在一定条件下遇氯化铁溶液呈紫色,符合上述条件的芳香族化合物有种。
乙酮互为同分异构体,分子中无甲基,在一定条件下遇氯化铁溶液呈紫色,符合上述条件的芳香族化合物有种。
下列反应类型:①取代②加成③消去④酯化⑤氧化⑥还原可在有机物中引入羟基的反应类型是。
写出下列化合物作为单体聚合生成的高分子化合物的结构简式:
(1)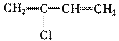 聚合得___________________________。
聚合得___________________________。
(2)已知 在虚线处开环聚合得
在虚线处开环聚合得 CH2CH2O
CH2CH2O n,则
n,则 开环聚合得_______________________________。
开环聚合得_______________________________。