铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应)。某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究。
A B C
Ⅰ.铁矿石中含氧量的测定
① 按上图组装仪器,检查装置的气密性;
② 将5.0g铁矿石放入硬质玻璃管中,装置B、C中的药品如图所示(夹持仪器均省略);
③ 从左端导气管口处不断地缓缓通入H2,待C装置出口处H2验纯后,点燃A处酒精灯
④ 充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却。
(1)装置C的作用为 。
(2)测的反应后装置B增重1.35g,则铁矿石中氧的百分含量为 。
Ⅱ.铁矿石中含铁量的测定
(1)步骤④中煮沸的作用是 。
(2)步骤⑤中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、 。
(3)下列有关步骤⑥的操作中说法正确的是 。
a.因为碘水为黄色,所以滴定过程中不需加指示剂
b.滴定过程中可利用淀粉溶液作为指示剂
c.滴定管用蒸馏水洗涤后可以直接装液
d.锥形瓶不需要用待测液润洗
e.滴定过程中,眼睛注视滴定管中液面变化
f.滴定结束后,30s内溶液不恢复原来的颜色再读数
(4)若滴定过程中消耗0.5000mol·L−1KI溶液20.00mL,则铁矿石中铁的百分含量为 。
Ⅲ.由Ⅰ、Ⅱ可以推算出该铁矿石中铁的氧化物的化学式为 。
过氧化镁MgO2易溶于稀酸,溶于酸后会产生过氧化氢,在医学上可作为“解酸剂”等。过氧化镁产品中常会混有一定量的MgO,实验室可通过多种方案测定样品中过氧化镁的含量。某研究小组拟用下图装置测定一定质量的样品中过氧化镁的含量。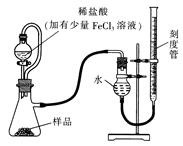
(1)实验前需进行的操作是:,稀盐酸中加入少量FeCl3溶液的作用是:。
(2)用恒压分液漏斗的优点有:①;②。
实验结束时,待恢复至室温,先,再平视刻度线读数。实验室还可通过下列两种方案来测定样品中过氧化镁的含量:
方案I:取a g样品,加入足量稀盐酸,充分反应后再加入 NaOH溶液至Mg2+沉淀完全,过滤、洗涤后,将滤渣充分灼烧,最终得到b g固体。
(3)推算该样品中过氧化镁的质量分数(用含a、b的表达式表示)。
方案Ⅱ:称取0.1 g样品置于某定量用锥形瓶中,加入15 mL0.6 mol/LKI溶液和足量盐酸,摇匀后在暗处静置5 min,然后用0.1000 mol/L Na2S2O3溶液滴定,滴定到终点时共消耗28.50 mL Na2S2O3溶液。(已知:I2+2Na2S2O3→Na2S4O6+2NaI)
(4)该实验在滴定前需加入少量作指示剂;判断到达滴定终点的现象是;
(5)推算该样品中过氧化镁的质量分数为。
水中因含有机物而具有较高的化学耗氧量。常用酸性KMnO4氧化有机物测其含量。主要操作步骤如下:
(1)仪器A为(填酸式或碱式)滴定管;要顺利完成实验,步骤Ⅲ中溶液颜色应为。
(2)完善步骤Ⅳ涉及的离子方程式:
C2O42—+MnO4—+=Mn2++CO2↑+
该步骤中KMnO4溶液紫色会逐渐褪去.某探究小组测得某次实验(恒温)时溶液中Mn2+物质的量与时间关系如图.
请解释n(Mn2+)在反应起始时变化不大、一段时间后快速增大的原因:
(3)若步骤Ⅳ中所用Na2C2O4溶液为20.00ml,已知滴定后的液面如图所示,请写出滴定前的液面读数。
(4)若实验测量结果比实际有机物含量偏高,分别从以下两个方面猜想:
猜想1:水样中Cl—影响
猜想2:配制Na2C2O4标液定容时。
(5)若猜想1成立,请根据资料卡片补充完善上述实验以消除Cl—影响。(限选试剂:AgNO3溶液、Ag2SO4溶液、KMnO4溶液、Na2C2O4溶液)。
资料卡片:
1、有机物可被HNO3氧化。
2、AgCl不与酸性KMnO4溶液反应。
3、Ag2C2O4可被酸性KMnO4溶液氧化。
为保护环境,节约资源,某研究性学习小组探究用易拽罐制取明矾[KAl(SO4)2·12H2O]。
查阅资料得知:明矾溶于水,不溶于乙醇:易拉罐主要成分为铝,另含有镁、铁等。
实验步骤如下:
步骤1、将易拉罐剪开,裁成铝片。用砂纸磨去表面的油漆,颜料及透明塑胶内衬:
步骤2、制备NaAlO2
称量1 g上述处理过的铝片,切碎,分数次放入盛有40mL5% NaOH溶液的烧杯中:将烧杯置于热水浴中加热。反应完毕后,溶液呈灰黑色浑浊,趁热过滤。
步骤3、氢氧化铝的生成和洗涤
在所得滤液中滴加3mol·L-1H2SO4溶液,用pH试纸检验,调节pH至8~9为止:此时溶液中生成大量的白色氢氧化铝沉淀,过滤,并用热蒸馏水多次洗涤沉淀
步骤4、明矾的制备
将过滤后所得氢氧化铝沉淀转入蒸发皿中,加10 mL 9mol/L H2SO4,再加15 mL水,小火加热使其溶解,加入4g硫酸钾继续加热至溶解,将所得溶液在空气中自然冷却,待结晶完全后,过滤,用无水酒精洗涤晶体两次;将晶体用滤纸吸干,制得明矾。
回答以下问题:
(1)步骤2中铝片溶于烧碱的反应建议在通风橱中进行,用热水浴加热,避免明火,原因是;过滤后,滤渣的主要成分是。
(2)步骤3中,若调节pH过低,导致的结果是;洗涤氢氧化铝沉淀的方法是。
(3)步骤4中用到的主要仪器是:铁架台(带铁圈),蒸发皿、量筒、漏斗、烧杯、酒精灯和;加入硫酸钾后制取明矾的化学反应方程式是。
(4)不用水而用无水酒精洗涤明矾晶体的原因是。
(5)实验验证明矾晶体中含有SO42—离子的方法是。
(6)该实验制得明矾15.8 g,则称取的1 g铝片中铝元素含量不低于%。
实验室欲配制80mL,1.5 mol/L的NaHCO3溶液,试回答:
(1)该实验必须使用的玻璃仪有;
(2)配置该溶液时应称取NaHCO3的质量为_____________________;(3)下列操作对上述所配溶液物质的量浓度的影响(填写无影响、偏高或偏低)
A.配制过程中未洗涤烧杯和玻璃棒;
B.容量瓶使用之前未烘干,有少量蒸馏水;
C.定容时俯视容量瓶的刻度线;
D.将所配溶液从容量瓶转移到试剂瓶时,有少量液体溅出;__________
写出下列反应的离子方程式:
A.向NaHCO3溶液中滴加盐酸
B.向Ba(OH)2溶液中滴加少量NaHCO3溶液
C.向氨水中滴加MgCl2溶液
(9分)某学生用已知物质的量浓度的盐酸来测定未知浓度的氢氧化钠溶液时,选择甲基橙作指示剂。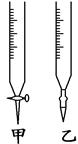
请填写下列空白:
(1)酸式滴定管用蒸馏水洗净后,接下来应该进行的操作是_________。
(2)用标准盐酸溶液滴定时,应将标准盐酸溶液注入________(填“甲”或“乙”)中。
(3)用标准的盐酸滴定待测的氢氧化钠溶液时,左手握酸式滴定管的活塞,右手轻轻摇动锥形瓶,眼睛注视_______________________________________________________。
(4)直到因加入一滴盐酸后,溶液颜色由________色变为________色,并在30 s内不变,即为终点。
(5)下列操作中可能使所测氢氧化钠溶液浓度偏大的是________。
| A.酸式滴定管未用标准盐酸润洗,直接装入标准盐酸。 |
| B.酸式滴定管滴定前有气泡,滴定后气泡消失。 |
| C.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后未干燥。 |
| D.读取盐酸体积开始时仰视读数,滴定结束后俯视读数。 |