铁及铁的化合物在生产、生活中有着重要的用途。
(1) 已知铁是26号元素,写出Fe的价层电子电子排布式________。已知自然界丰度最大的铁的同位素是中子数为30的铁原子,则该种同位素符号________。
(2) Fe原子或离子外围有较多能量相近的空轨道,因此能与一些分子或离子形成配合物,则与之形成配合物的分子的配位原子应具备的结构特征是________。Fe(CO)3一种配合物,可代替四乙基铅作为汽油的抗爆震剂,其配体是CO分子。写出CO的一种常见等电子体分子的结构式________;两者相比较,沸点较髙的是________填分子式)。
(3) 1183K以下纯铁晶体的晶胞如图1所示,1183K以上则转变为图2所示晶胞,在两种晶体中最邻近的铁原子间距离相同。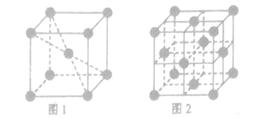
①图1和图2中,铁原子的配位数之比为________。
②空间利用率是指构成晶体的原子、离子或分子在整个晶体空间中占有的体积百分比,则图1和图2中,铁原子的空间利用率之比为________。
根据图示及描述,回答下列问题: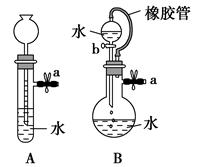
(1)关闭图A装置中的止水夹a后,从长颈漏斗向试管口注入一定量的水,静置后如图所示。试判断:A装置是否漏气?(填“漏气”、“不漏气”或“无法确定”),判断理由。
(2)关闭图B装置中的止水夹a后,开启活塞b,水不断往下滴,直至全部流入烧瓶。试判断:B装置是否漏气?(填“漏气”、“不漏气”或“无法确定”),判断理由。
【物质结构与性质】金属元素在自然界中分布很广,其中铜等在生产生活中有着广泛的应用。
(1)科学家通过X射线推测胆矾结构示意图如下所示,
①写出基态Cu原子的核外电子排布式 ;金属铜采用下列 (填字母代号)堆积方式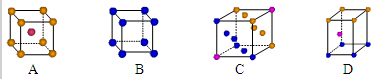
②胆矾中含有的微粒间作用力有 (填字母代号)。
a.离子键 b.极性键 c.金属键 d.配位键 e.氢键 f.非极性键
③铜离子形成胆矾中配离子的离子方程式为: ;
(2)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用醋酸二氨合铜(I)溶液来吸收原料气体中的CO(Ac-表示CH3COO-),其反应是:
[Cu(NH3)2] Ac +CO+NH3[Cu(NH3)3]Ac·CO[醋酸羰基三氨合铜(I)] △H<0
①C、N、O三种元素的第一电离能由小到大的顺序为 。
② 氨分子中N原子的杂化方式为 。
(3)铜的化合物种类也很多,其常见价态为+1、+2价。如CuO、Cu2O、CuH等。右图是铜的一种氯化物晶体的晶胞结构,则它的化学式是 。
【化学工艺与技术】电镀污泥是指电镀废水处理后产生的污泥和镀槽淤泥,被列入国家危险废物名录,属于第十七类危险废物。处置电镀污泥回收有价金属,既可以最低限度的降低环境污染,又可以最大限度地节约资源,可谓一举两得。电镀污泥中含有Cr(OH)3、Al(OH)3、Zn(OH)2、CuO、NiO等物质,工业上通过“中温焙烧-钠氧化法”回收Na2Cr2O7等物质。
已知:①水浸后溶液中存在Na2CrO4、NaAlO2、Na2ZnO2等物质
②除去滤渣2后,溶液中存在如下反应:2 + 2H+
+ 2H+
 + H2O
+ H2O
③不同钠盐在不同温度下的溶解度如下表:
| 温度 化学式 |
20℃ |
60℃ |
100℃ |
| Na2SO4 |
19.5 |
45.3 |
42.5 |
| Na2Cr2O7 |
183 |
269 |
415 |
| Na2CrO4 |
84 |
115 |
126 |
(1)完成氧化焙烧过程中生成K2CrO4的化学方程式。 Cr(OH)3+ Na2CO3+ Na2CrO4+ CO2 + ________
Cr(OH)3+ Na2CO3+ Na2CrO4+ CO2 + ________
(2)水浸后的溶液呈 (填“酸”、“碱”、“中”)性,该步骤过滤,在滤渣1中可进一步回收到重金属 。
(3)滤渣2的主要成分有Zn(OH)2、
(4)系列操作中继续加入H2SO4,加热蒸发,冷却结晶,过滤;继续加入H2SO4目的是______,可得到滤渣3的主要成分为 。
(5)工业上还可以在水浸过滤后的Na2CrO4溶液中加入适量H2SO4,用石墨做电极电解生产金属铬,写出生成铬的电极反应方程式:_______________________________。
摩尔盐是硫酸盐中带有结晶水的一种复盐,是一种重要化工原料,其组成可通过下列实验测定:定性检验:①配制莫尔盐的溶液,取它的水溶液,加入KSCN不显红色,再滴入几滴新制氯水溶液显红色;另取莫尔盐溶液,逐滴加入NaOH溶液,发现反应生成白色沉淀A,很快沉淀颜色发生改变,继续滴加NaOH溶液,又发现沉淀逐渐增多,继续滴加至过量后沉淀又部分溶解,最终生成沉淀B。
定量测定:②称取1.8520 g样品,准确配成100 mL溶液A;
③量取25.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤,干燥至恒重,得到白色固体0.4660 g;
④再量取25.00 mL溶液A,滴加适量稀硫酸,用0.0100 mol·L-1KMnO4溶液滴定至终点,生成Mn2+,消耗KMnO4溶液10.00 mL。
请回答一下问题:
(1)写出①中物质的化学式A ,B ;
(2)已知室温下BaSO4的Ksp=1.1×10-10,欲使溶液中c(SO42-)≤1. 0×10-5mol·L-1,则应保持溶液中c(Ba2+)≥ mol·L-1;
(3)③中发生反应的离子方程式为 ,滴定终点的现象是 ;
(4)通过计算确定样品的组成(必须写出计算过程)。
四氧化三铁是一种常用的磁性材料,纯净的四氧化三铁用来作录音磁带和电讯器材的原材料。下图是氧化沉淀法生产Fe3O4工艺流程示意图: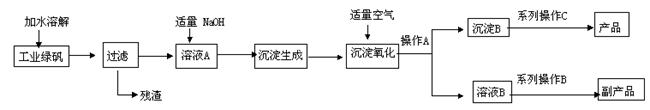
已知:①工业绿矾中的杂质不溶于水,不参与反应;②Fe(OH)2 +2Fe(OH)3 =Fe3O4 +4H2O 。
请回答下列问题:
(1)铁的常见氧化物中可用作颜料的化学式是 。
(2)加水溶解过程中,实验室通常使用的玻璃仪器有 ,操作A的名称是 ,与加水溶解的过程中用到不同的玻璃仪器是 。
(3)在工艺流程中,通入适量空气氧化时的化学方程式为 。
(4)由溶液B获得该副产品要经历以下步骤,请排出正确的操作顺序是 (填字母编号),得到副产品的化学式为 。
a.过滤 b.加热浓缩 c.结晶 d.冷却 e.洗涤
(5)Fe3O4与稀硝酸恰好完全反应时,氧化剂与还原剂的物质的量之比为 。