Na、Fe、Cu、Al是常见的金属元素,请按要求回答下列问题:
(1)一定条件下,2.3g的Na完全与O2反应生成3.6g产物时失去的电子数为______。
(2)向氯化铜溶液中加入一定量的铁粉和铝粉混合物,充分反应后,下列情况可能出现的是______(填编号)。
a.溶液中有Cu2+、Fe2+、Al3+,不溶物为Cu b.溶液中有Fe2+、Al3+,不溶物为Cu、Fe
c.溶液中有Fe3+、Al3+,不溶物为Cu d.溶液中有Fe2+,不溶物为Cu、Al
(3)将一定质量的铁、铝、铜合金,加入lL一定物质的量浓度的硝酸中,合金完全溶解,测得溶液中(忽略溶液体积的变化)c(H+)=0.5mol/L、c(Cu2+)=0.3mol/L、c(Al3+)=0.2mol/L、c(NO3-)=2mol/L,则混合物中铁的质量为______。
(4)铁的某种氧化物的化学式表示为FexO(x<1),已知铁元素在该氧化物中的质量分数为75%,则x=______ (精确至0.01)。
(5)Na-AI/FeS是一种可充电电池,电池中用含Na+导电固体作为电解质,在工作过程中Na+的物质的量保持不变。
①若该正极的电极反应式表示为:2Na++FeS+2e-=Na2S+Fe,则电池的负极反应式可表示为_____;充电时,阳极发生反应的物质是______。
②用该电池作电源,组成如图所示装置,若通电5min时,铜电极质量增加1.08 g,则该电源电极X名称为______。图中装置A、C的pH变化为:A ______、C ______(填“增大”“减小”或“不变”)。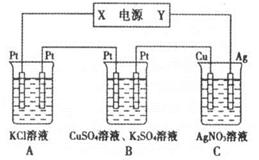
热重分析法是程序控制温度下,测量物质的质量与温度的关系的一种实验技术。现有一CaC2O4·nH2O试样,分别在氮气气氛、氧气气氛中进行热重分析,得到如下热重(TG)曲线。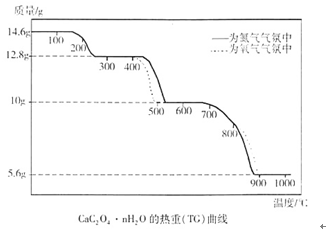
(1)图中曲线上有三个失重台阶,分别表示加热过程中依次发生了三个反应。根据第1步反应的失重数据计算试样CaC2O4·nH2O中的n值(精确到整数)为。
(2)根据第2步反应的失重数据推测第2反应的化学方程式为;观察曲线说明氧气存在时有利于第2步反应进行,原因是。
(3)第3步反应中释放的气体产物是。观察曲线可判断出,氧气存在时不利于第3步反应进行,可能原因是。
元素X、Y、Z、M、Q均为短周期主族元素,且原子序数依次增大。已知元素Y最高价氧化物对应水化物与它的氢化物反应能生成一种盐;Z原子最外层电子数与核外电子总数之比为3:4;M可与Z形成阴、阳离子个数比为1:2的两种化合物,Q原子的最外层电子数与次外电子数之比为3:4,YX3常温下为气体。
(1)化合物A、B由X、Z、M、Q四种元素中的三种组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比均为1:1:1,若A能抑制水的电离,B能促进水的电离,则化合物A的化学式为,B的化学式是。
(2)Se是人体必备的微量元素,与Q同一主族。该族二至五周期元素单质分别与H2反应生成1mol 气态氢化物的反应热如下,表示生成1 mol哂化氢反应热(△H)的是(填字母代号)。
A.+99.7kJ·mol-1B.+29.7 kJ·mol-1
C.-20.6 kJ·mol-1D.-241.8 kJ·mol-1
(3)X与Z、X与Q均可形成18电子分子甲和乙,写出甲、乙两种分子在水溶液中反应生成Q单质的化学方程式。X和Y也可形成18电子分子丙,它通常是一种液态火箭燃料。25℃、常压下,3.2g丙在氧气中完全燃烧放出热量为62.4kJ,请写出丙完全燃烧的热化学反应方程式。
(4)X、Y两种元素形成的离子化合物的电子式为。
常用作风信子等香精的定香剂D以及可用作安全玻璃夹层的高分子化合物PVB的合成路线如下:
已知:
(1)A的核磁共振氢谱有两种峰,A的名称是
(2)B的结构简式是
(3)C为反式结构,由B还原得到。C的结构式是
(4)E能使Br2的CCl4溶液褪色,除此之外,E还能发生下列哪些化学反应:
a.加成反应 b.氧化反应 c.加聚反应 d.消去反应
(5)a. ②的反应类型是;b. ③的化学方程式是。
(6)PVAc由一种单体经加聚反应得到,该单体的结构简式是。
肉桂醛在食品、医药、化工等方面都有应用。肉桂酸甲酯是常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精.
(1)肉桂醛由C、H、O三种元素组成,且质谱分析肉桂醛分子的相对分子质量为132,其分子中碳、氢、氧三种元素的质量比为27: 2: 4。则肉桂醛的分子式是。肉桂醛可视为苯的一取代物,核磁共振氢谱显示,苯环侧链上有三种不同化学环境的氢原子,其结构简式是。(不考虑顺反异构)
(2)肉桂醛能被银氨溶液氧化,再经酸化得到肉桂酸。写出肉桂醛被银氨溶液氧化的反应方程式:。
(3)现用芳香烃A 为原料合成H的路线如下,已知A分子中只有一个侧链: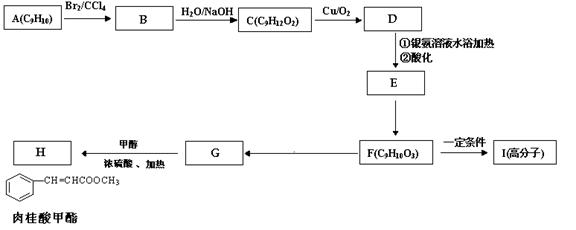
①书写化学方程式
F→I;F→G;
②G的同分异构体中,属于酯类且苯环上只有一个取代基的同分异构体有种。请写出任意一种的结构简式:。
《茉莉花》是一首脍炙人口的江苏民歌。茉莉花香气的成分有多种,乙酸苯甲酯( )是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下:
)是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下: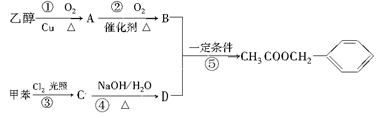
(1)在①②③④⑤五个反应中,属于取代反应的是:(填序号);
(2)A中的含氧官能团的名称是:;
(3)C的结构简式为:;
(4)反应⑤的化学方程式为:;