汞(Hg)、铬(Cr)是影响环境污染、生物效应和人类健康的重金属元素。
I、铬广泛应用于钢铁工业、磁带和录像带等方面。
(1)工业常采用“铝在高温条件下还原铬绿(Cr2O3)”制备铬单质,该反应的化学方程式为 。
II、含铬的工业废水会导致慢性中毒。处理含+6价铬的废水时可得到铁氧体(其组成可写作[Fe2+Fe3+(2-x) Cr3+x]O4)。
(2)加过量FeSO4的目的是 。
(3)配平步骤①的反应的离子方程式 Fe2++ Cr2O72—+ _____="=" Fe3++ Cr3++ H2O
并计算铁氧体( [Fe2+Fe3+(2-x) Cr3+x]O4)中X= _________________。
(4)下表是实验检测中心对某地区二个点的土壤样品(每个点分三层取样,共6个样品)进行了有机质和铬总量的测定,结果见下表。
| 样品序号 |
取样深度(m) |
有机质(×10—2g) |
总铬(×10—6g) |
| 样品A-1 |
0.00 ~ 0.30 |
2.81 |
114 |
| 样品A-2 |
0.30 ~ 0.60 |
1.72 |
111 |
| 样品A-3 |
1.20 ~ 1.80 |
1.00 |
88 |
| 样品B-1 |
0.00 ~ 0.30 |
2.60 |
116 |
| 样品B-2 |
0.30 ~ 0.60 |
2.48 |
112 |
| 样品B-3 |
1.20 ~ 1.80 |
1.83 |
106 |
从表中你可以得出的结论有 (答一点即可)。
(5)工业上以铬酸钾(K2CrO4)为原料,电化学法制备重铬酸钾,装置如图。反应为:4K2CrO4+4H2O 2K2Cr2O7+4KOH+2H2↑+O2↑已知K2CrO4铬酸钾溶液中存在平衡:2CrO42-(黄色)+2H+
2K2Cr2O7+4KOH+2H2↑+O2↑已知K2CrO4铬酸钾溶液中存在平衡:2CrO42-(黄色)+2H+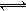 Cr2O72-(橙色)+H2O通电后阳极区溶液由 变为 。原因是 。
Cr2O72-(橙色)+H2O通电后阳极区溶液由 变为 。原因是 。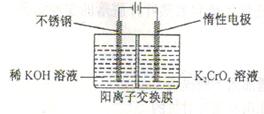
(12分)
(一)大气中的部分碘源于O3对海水中I-的氧化。将O3持续通入NaI溶液中进行模拟研究.
(1)O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+ O3(g)= IO-(aq)+O2(g) △H1
②IO-(aq)+H+(aq) HOI(aq) △H2
HOI(aq) △H2
③HOI(aq) + I-(aq) + H+(aq) I2(aq) + H2O(l) △H3
I2(aq) + H2O(l) △H3
总反应的化学方程式为______,其反应△H=______。
(2)在溶液中存在化学平衡:I2(aq)+I-(aq) I3-(aq),其平衡常数表达式为。
I3-(aq),其平衡常数表达式为。
(二)能量之间可以相互转化:原电池可将化学能转化为电能。
(1)下列反应能设计成原电池的是:。
①2FeCl3+Fe=3FeCl2.C
②AlCl3+3NH3·H2O= Al(OH)3↓+3NH4Cl
③NaOH+HC1=NaC1+H2O
(2)根据(1)所选的反应设计成原电池如图,请在图中完成并作相应标注。
写出该电池的正极反应式:,电池工作的时候,盐桥中的阴离子移向(填“负极”,“正极”或“不移动”)。
(3)用FeCl3溶液腐蚀印刷电路铜板的化学方程式为:;
若将该反应设计成下图的原电池,请在图中完成电极材料及电解质溶液的标注。
下图是元素周期表的一部分,针对表中的①~⑥元素,回答下列问题
| 主族 周期 |
ⅠA |
0族 |
||||||
| 一 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 二 |
② |
③ |
||||||
| 三 |
④ |
⑤ |
⑥ |
(1)最活泼的金属元素是(填元素符号),②和⑤两种元素原子半径较大的是(填元素符号),⑤和⑥两种元素最高价氧化物对应的水合物酸性较强的元素是(填元素符号);
(2)写出①单质在⑥单质中燃烧的化学方程式。
(3)①②③三种元素能够形成多种有机化合物,其中一种不仅是厨房调味剂而且还能除去水垢。写出此物质的结构简式:;写出该物质与NaHCO3反应的化学方程式:____________。
将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如下图所示装置。试回答下列问题:
Ⅰ.若电解质溶液为稀硫酸
(1)Zn棒为原电池的极,其电极反应式为。
(2)Cu棒为原电池的极,其电极反应式为。
Ⅱ.若电解质为硫酸铜溶液,
(3)Cu棒上发生反应。
(4)若在上述两个过程中,转移电子数相等,则Cu棒上Ⅰ和Ⅱ所析出物质的质量之比为。
(8分)请选择合适选项填空(用字母序号填空):
| A.He |
| B.Cu |
| C.H2 |
| D.NaCl |
E.KOH
F.H2O
(1)属于共价化合物的是________;
(2)含共价键的单质有________;
(3)只含有离子键的化合物有________;
(4)既有离子键又有共价键的化合物_________。
下表是元素周期表的一部分:
针对表中的①~⑩号元素,用元素符号或化学式填空:
(1)在这些元素中,最易失电子的元素是,非金属性最强的元素是。
(2)化学性质最不活泼的元素是,其原子结构示意图为。
(3)元素的最高价氧化物对应的水化物中呈两性的氢氧化物与氢氧化钠溶液反应的离子方程式是。
(4)在②⑤⑦⑨四种元素中,原子半径由大到小的顺序是。
(5)元素⑥、⑩的最高价氧化物对应的水化物中,酸性较强的是。