A、B、C、D、E、F六种元素为原子序数依次增大的短周期元素。A为原子半径最小的元素,A和B可形成4原子10电子的分子X;C的最外层电子数是内层的3倍; D原子的最外层电子数是最内层电子数的一半;E是地壳中含量最多的金属元素;F元素的最高正价与最低负价代数和为6。
请回答下列问题:
(1)B、C、D、E、F五种元素原子半径由大到小的顺序是________。
(2)A和C按原子个数比1:l形成4原子分子Y.Y的结构式是________。
(3)分子X的电子式是_____________;D可以在液态X中发生类似于与A2C的反应,
写出反应的化学方程式_________________________________ 。
(4)实验证明,熔融的EF3不导电,其原因是__________________________。
(5)E的单质可溶于A、C、D形成的化合物Z的水溶液中。拉曼光谱证实此反应生成的阴离子主要以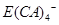 的形式存在,写出E溶于Z溶液的离子方程式:_________________________________________.
的形式存在,写出E溶于Z溶液的离子方程式:_________________________________________.
(6)工业品Z的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。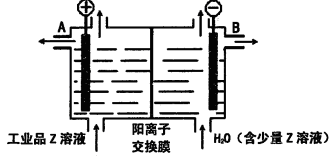
①该电解槽的阳极反应式是____________________。
②通电开始后,阴极附近溶液pH_________________(“增大”、“减小”或”不变”)。
③除去杂质后的Z溶液从液体出口___________________(填写“A”或“B”)导出。
(1)对工业合成氨条件的探索一直是化学工业的重要课题,在恒温恒容的甲容器、恒温恒压的乙容器中分别进行合成氨反应,如下图(图中所示数据均为初始物理量)。t分钟后反应均达到平衡,生成NH3均为0.4mol(忽略水对压强的影响及氨气的溶解)。
①判断甲容器中的反应达平衡的依据是。(填写相应编号)
| A.压强不随时间改变 |
| B.气体的密度不随时间改变 |
| C.c(N2)不随时间改变 |
| D.单位时间内生成2molNH3的同时消耗1molN2 |
E.单位时间内断裂3 mol H-H键,同时断裂6 mol N-H键
②该条件下甲容器中反应的平衡常数K= ;平衡时,甲的压强p平 = (初始压强用p0表示)。
③该条件下,若向乙中继续加入0.2mol N2,达到平衡时N2转化率= 。
(2)最近华南理工大提出利用电解法制H2O2并用产生的H2O2处理废氨水,装置如下图
①为了不影响H2O2的产量,需要向废氨水加入适量硝酸调节溶液的pH约为5,则所得废氨水溶液中
c(N )c(N
)c(N )
)
(填“>”、“<”或“=”)。
②Ir-Ru惰性电极有吸附O2作用,该电极上的反应为。
③理论上电路中每转移3mol电子,最多可以处理NH3·H2O的物质的量为。
四川北川盛产蔷薇科植物。蔷薇科植物中含有一种芳香醛(用E表示),在染料工业和食品工业上有着广泛的用途,下面是它的一种合成路线。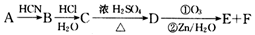
其中0 . l mol有机物A的质量是 12g ,在足量的氧气中充分燃烧后生成0.8mol CO2和 7.2gH2O; D 能使溴的四氯化碳溶液褪色, D 分子与 C 分子具有相同的碳原子数;F继续被氧化生成G,G 的相对分子质量为 90 。
已知: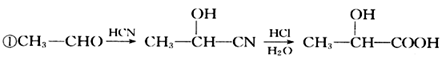

回答下列问题:
(1)A 的结构简式为__________________。
(2)A~G中能发生酯化反应的有机物有:(填字母序号)。
(3)C在浓硫酸加热的条件下时,分子内脱水除生成D外还可以生成另一种有机物,写出该反应的方程式:;该反应类型;
(4)C 的同分异构体有多种,其中符合下列要求的有机物有多种。
①能与3 mol NaOH溶液反应;
②苯环上的一卤代物只有一种
写出所有满足条件有机物的结构简式______________________________
(5)C与4-甲基-2,3-戊二醇两分子之间1:1发生取代反应,生成的有机物有种。
(1)一定温度下,向1 L 0.1 mol·L-1 CH3COOH溶液中加入0. 1 mol CH3COONa固体,则醋酸的电离平衡向________(填“正”或“逆”)反应方向移动;溶液中 的值________(填“增大”、“减小”或“不变”)。
的值________(填“增大”、“减小”或“不变”)。
(2)氨气的水溶液称为氨水,其中存在的主要溶质微粒是NH3·H2O。
已知:a.常温下,醋酸和NH3·H2O的电离平衡常数均为1.74×10-5;
b.CH3COOH+NaHCO3===CH3COONa+CO2↑+H2O。
则CH3COONH4溶液呈________性(填“酸”、“碱”或“中”,下同),NH4HCO3溶液呈________性,NH4HCO3溶液中物质的量浓度最大的离子是________(填化学式)。
(3)99 ℃时,Kw=1.0×10-12,该温度下测得0.1 mol·L-1 Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为___________________。
②该温度下,将0.01 mol·L-1 H2A溶液稀释到20倍后,溶液的pH=________。
③体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气________。
| A.盐酸多 | B.H2A多 | C.一样多 | D.无法确定 |
④将0.1 mol·L-1 H2A溶液与0.2 mol·L-1氨水等体积混合,完全反应后溶液中各离子浓度从大到小的顺序为_____________________。
(1)实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为22.4 L。请回答下列问题:
MnCl2+Cl2↑+2H2O,取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为22.4 L。请回答下列问题:
①写出该反应的离子反应方程式________________,
②反应中被氧化的HCl的物质的量为________mol。
③实验室备用的浓盐酸质量分数为36.5%,密度为1.19 g·cm-3,为使用方便,请计算出该浓盐酸的物质的量浓度_________ molL-1。
(2)把一小块镁铝合金溶于100mL盐酸中,然后向其中滴入1 molL-1NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积如下图所示。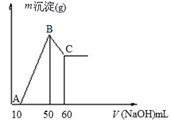
①合金中镁的质量g。
②盐酸的物质的量浓度molL-1
姜黄素具有防肿瘤的作用,工业上可以通过中间体E合成。
I合成中间体E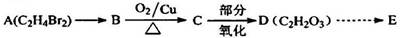
(1)A→B的反应方程式为____。
(2)D的官能团名称为;c中处于同一平面上的原子最多个。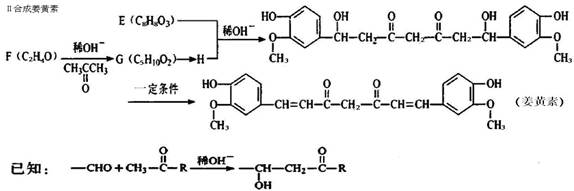
(3)F—→G的化学方程式为;G→H的反应类型为。
(4)中间体E的结构简式为;
将F滴人新制Cu(OH)2悬浊液,加热,观察到的现象是____。
(5)写出所有符合下列条件的E的同分异构体的结构简式。
①能与N a反应 ②苯环上一卤代物只有一种 @含﹥c= c﹤