[化学选修——2:化学与技术](15分)
海水是巨大的资源宝库,利用海水提取食盐的过程如图所示。回答下列问题: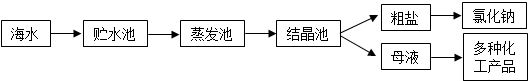
(1)①粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用试剂为:A:盐酸;B:BaCl2溶液;C:NaOH溶液;D:Na2CO3溶液。加入试剂的顺序是 。
②电解饱和食盐水时,与电源正极相连的电极上发生的反应为 ,与电源负极相连的电极附近溶液pH的变化是 。
(2)工业上从海水中提取的NaCl,可用来制取纯碱,其简要过程如下:向饱和食盐水中先通入气体A,后通入气体B,充分反应后过滤得到晶体C和滤液D,将晶体C灼烧即可制得纯碱,①则气体B是 (填化学式),由NaCl制取纯碱反应的化学方程为 、 。
(3)采用空气吹出法从浓海水吹出Br2,并用纯碱吸收.碱吸收溴的主要反应是Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3,吸收3mol Br2时,转移的电子数为 个。
(4)海水提镁的一段工艺流程如图: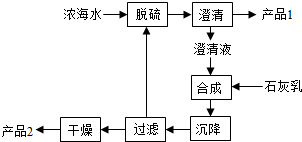
浓海水的主要成分如下:
| 离子 |
Na+ |
Mg2+ |
Cl- |
SO42- |
| 浓度/(g•L-1) |
63.7 |
28.8 |
144.6 |
46.4 |
该工艺过程中,脱硫阶段主要反应的离子方程式为 ,1L浓海水最多可得到产品2的物质的量为 mol。
扑热息痛(学名对乙酰氨基酚)是生活中常用到的一种解热镇痛药。以苯为原料合成扑热息痛的部分转化如下:
 A
A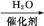 B
B C
C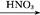
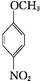 →…→D
→…→D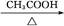
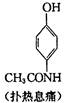
请回答下列问题:
(1)B→C的反应类型为 ,D中官能团的名称为 。
(2)C的结构简式为 。
(3)1 mol 扑热息痛与足量NaOH溶液反应,理论上消耗NaOH的物质的量为 mol。
(4)实验证明B能够与溴水反应,试写出其反应的化学方程式: 。
(5)扑热息痛有多种同分异构体,同时符合下列要求的同分异构体有 种。
①苯环上有两个对位取代基 ②属于氨基酸
011年5月份,受到拉尼娜现象和全球大气环流异常共同作用的影响,我国南方出现了罕见的旱情,为此专家建议尽快发展高能抗旱保水剂用来调控农田水分和作物耗水,减缓水资源短缺和干旱的危害。已知有机物I为一种保水剂,可通过烃A经下列转化生成:
提示: 不能稳定存在。
不能稳定存在。
请回答下列问题:
(1)A和I的结构简式为:A ,I 。
(2)F中官能团的名称为: 。
(3)反应②和⑦的反应类型为:② ,⑦ 。
(4)反应④的化学方程式为 。
(5)M是一种普遍使用的抗生素类药物,它是由2个F分子在一定条件下脱去2个水分子形成的环状酯,写出该反应的化学方程式: 。
(6)D有两种能发生银镜反应且属于链状化合物的稳定同分异构体,请写出它们的结构简式: 。
 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
(1)写出G的含氧官能团的名称 ;B→C的反应类型是 。
(2)写出D E的化学方程式: 。
E的化学方程式: 。
(3)满足下列条件的D的同分异构体有 种。
①能发生银镜反应;②能使FeCl3溶液显色;③酯类。
(4)下列关于G的说法正确的是
a.能使溴水褪色
b.能与金属钠反应
c.1 mol G最多能和3 mol氢气反应
d.分子式是C9H8O3
某烃A的相对分子质量为84。回答下列问题:
(1)下列物质与A以任意比例混合,若总物质的量一定,充分燃烧消耗氧气的量不相等的是(填序号) 。
a.C7H12O2 b.C6H14 c.C6H14O d.C7H14O3
(2)若烃A为链烃,与HBr加成后只能得到一种产物,且该烃的一氯代物只有一种。
①A的结构简式为 ;
②链烃A与溴的CCl4溶液反应生成B,B与NaOH的醇溶液共热可得到D,D分子中无溴原子。请写出由B制备D的化学方程式:;
③B与足量NaOH水溶液完全反应,生成有机物E,该反应的化学方程式:;E与乙二醇的关系是。
(3)若核磁共振氢谱显示链烃A有三组不同的峰,峰面积比为3∶2∶1,则A的名称为。
(4)若A不能使溴水褪色,且其一氯代物只有一种,则A的结构简式为。
某有机化合物A经李比希法测得其中含碳为70.59%、含氢为 5.88%,其余含有氧。现用下列方法测定该有机化合物的相对分子质量和分子结构。
方法一:用质谱法分析得知A的相对分子质量为136。
方法二:核磁共振仪测出A的核磁共振氢谱有4个峰,其面积之比为1∶1∶1∶3。如下图A。
方法三:利用红外光谱仪测得A分子的红外光谱,如下图B。

(1)分子中共有 种化学环境不同的氢原子。
(2)A的分子式为 。
(3)该物质属于哪一类有机物 。
(4)A的分子中只含一个甲基的依据是 (填序号)。
a.A的相对分子质量
b.A的分子式
c.A的核磁共振氢谱图
d.A分子的红外光谱图
(5)A的结构简式为 。
(6)A的芳香类同分异构体有多种,其中又同时符合下列条件:①能发生水解反应;②分子结构中含有一个甲基。则该芳香类A的同分异构体共有 种。