某厂废水中含量金属Cr3+(含有少量Fe3+、Cu2+)。某研究性学习小组为了变废为宝,将废水处理得到重铬酸钾。某含铬废水处理的主要流程如图所示:
已知:① 沉淀完全,而在pH≥3.2时
沉淀完全,而在pH≥3.2时
Fe(OH)3沉淀完全。
②CrO2—4在酸性环境中发生:
回答下列问题:
(1)滤渣的成分是 。(写化学式)
(2)写出第③步反应的离子方程式 。
(3)分离出含[Cr(OH)4]—的溶液需要的玻璃仪器有 。
(4)目前一种采用以铬酸钾为原料,电化学法制备重要铬酸钾的实验装置示意图如下: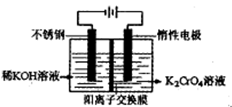
电解一段时间后,测定阳极液中K元素和Cr元素的含量,若K元素与Cr元素的物质的量之比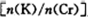 为d,则此时的铬酸钾的转化率为 。
为d,则此时的铬酸钾的转化率为 。
苯酚是重要的化工原料,通过下列流程可合成阿司匹林、香料和一些高分子化合物。
已知: 乙酸酐用AS表示,其结构式为


(1)C中含有官能团的名称为。
(2)写出反应⑦的化学方程式。
(3)写出G的结构简式。
(4)写出反应类型:①④。
(5)下列可检验阿司匹林样品中混有水杨酸的试剂是。
A. 三氯化铁溶液 B. 碳酸氢钠溶液 C.石蕊试液
(6)任意写出一种符合下列条件的B的同分异构体
(a)苯环上只有两个取代基
(b)能发生银镜反应
(c)苯环上的一溴代物有两种
(d)加入NaHCO3溶液能产生使澄清石灰水变浑浊的气体
材料是人类赖以生存的重要物质基础。铜、镍等金属材料在现代社会中有着重要应用。请回答下列问题:
(1)铜在元素周期表中的位置为,镍的基态电子排布式为。
(2)在配离子[Ni(NH3)4]2+中,配体中N元素与它相邻的C和O元素的第一电离能由大到小的顺序为,这三种元素电负性由大到小的顺序为;配体NH3中N原子的杂化方式为。
(3)据报道,只含镁、镍和碳三种元素的晶体竟然也具有超导性。鉴于这三种元素都是常见元素,从而引起广泛关注。该晶体的结构可看作由镁原子和镍原子在一起进行面心立方最密堆积,如图,晶体中每个镁原子周围距离最近的镍原子有个,若已知晶胞的边长为a pm,阿伏伽德罗常数为NA,则该晶体的密度的数学表达式为g•cm-3(用a和NA表示,只列式,可不用化简)。
高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:
|

| 湿法 |
强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 |
Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(3)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为 。
甲醇汽油是由10%一25%的甲醇与其他化工原料、添加剂合成的新型车用燃料,可达到国标汽油的性能和指标。甲醇是一种可再生能源,具有广泛的开发和应用前景。
Ⅰ、工业上合成甲醇一般采用下列反应:CO(g)+2 H2(g) CH3 OH(g) △H="a" kJ/mol,
CH3 OH(g) △H="a" kJ/mol,
下表是该反应在不同温度下的化学平衡常数(K):
| 温度/0C |
250 |
310 |
350 |
| K |
2.041 |
0.250 |
0.012 |
(1)由表中数据判断△H a0(填“>”、“=”或“<”)。
(2)某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应达到平衡后,测得c(CO)="0.5" mol·L-1,则此时的温度为0C。
(3)在容积固定的密闭容器中发生上述反应,各物质的浓度如下表:
| 浓度mol/L 时间/min |
c(CO) |
c(H2) |
c(CH3OH) |
| 0 |
0.8 |
1.6 |
0 |
| 2 |
0.6 |
1.2 |
0.2 |
| 4 |
0.3 |
0.6 |
0.5 |
| 6 |
0.3 |
0.6 |
0.5 |
①反应从2 min到4 min之间,H2的反应速率为。
②反应达到平衡时CO的转化率为。
③反应在第2 min时改变了反应条件,改变的条件可能是(填序号)。
A.使用催化剂 B.降低温度 C.增加H2的浓度
(4)向容积相同、温度分别为T1和T2的两个密闭容器中均充入1 molCO和2 mol H2,发生反应CO(g)+2 H2(g) CH3 OH(g)△H="a" kJ/mol。恒温恒容下反应相同时间后,分别测得体系中CO的百分含量分别为w1和w2;已知T1<T2,则
CH3 OH(g)△H="a" kJ/mol。恒温恒容下反应相同时间后,分别测得体系中CO的百分含量分别为w1和w2;已知T1<T2,则
w1w2(填序号)。
A.大于B.小于C.等于D.以上都有可能
Ⅱ、甲醇在化学电源方面也有着重要应用。写出以甲醇为燃料,氢氧化钠溶液为电解质溶液的原电池中负极的电极反应式:。
化合物X(C12H13O4Br)是一种重要化工原料,存在如下转化关系: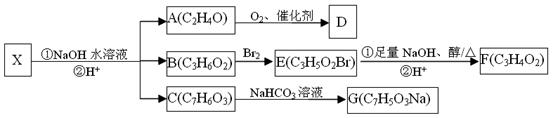
已知:①与官能团直接相连的碳原子称为α-C,α-C上的H称为α-H,易被取代。
②通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。.
根据以上信息回答:
(1)已知D能与碳酸氢钠反应生成二氧化碳,则D中官能团的名称是___________,检验A物质是否完全反应可选用的试剂是_______(填编号)。
①银氨溶液②氯化铁溶液
③氢氧化钠的酚酞溶液④新制氢氧化铜的悬浊液
(2)B→E的反应类型是_____________。
(3)已知F在一定条件下可以发生加聚反应生成高分子化合物,写出E和足量NaOH的醇溶液加热反应的化学方程式___________________________________。
(4)C的同分异构体中遇氯化铁溶液显紫色,且能发生银镜反应的物质共有种,请任写一种物质的结构简式______________。