某芳香族化合物A的分子中含有C、H、 O、N四种元素,相同状况下,其蒸气的密度氢气密度的68.5倍。现以苯为原料合成A,并最终制得F(一种染料中间体),转化关系如下: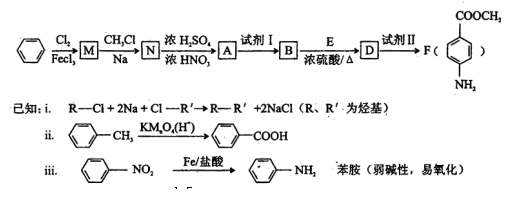
请回答下列问题:
(1)写出A的分子式_______________;A的结构简式_____________________。
(2)N-A的反应类型是__________________。
(3)①上述转化中试剂I和试剂II分别是:试剂I_________,试剂II__________(选填字母)。
a.KMnO4(H+) b.Fe/盐酸 c.NaOH溶液
②若上述转化中物质A依次与试剂Ⅱ、试剂I、化合物E(浓硫酸/△)作用,能否得到F,为什么?______________________________________________________________。
(4)用核磁共振氢谱可以证明化合物E中含有________种处于不同化学环境的氢。
(5)写出同时符合下列要求的两种D的同分异构体的结构简式_________________。
①嘱于芳香族化合物,分子中有两个互为对位的取代基,其中—个取代基是硝基;
②分子中含有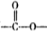 结构。
结构。
(6)有一种D的同分异构体W,在酸性条件下水解后,可得到一种能与溶液发生显
色反应的产物,写出W在酸性条件下水解的化学方程式_________________________。
(7)F的水解反应如下: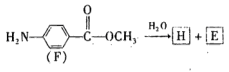
化合物H在一定条件下经缩聚反应可制得高分子纤维,广泛用于通讯、导弹、宇航等领域。请写出该缩聚反应的化学方程式____________________________________________。
(1)给下列物质命名或写出结构简式:
(2)葡萄糖的结构简式
(3)乙酸与CH3CH218OH发生酯化反应的化学方程式,并注明反应条件
填写下列空白:
(1)写出表示含有8个质子、10个中子的原子的化学符号:;
(2)周期表中最活泼的非金属元素位于第族;
(3)所含元素种类是8种的周期是第、周期。
(4)氯元素在周期表中位于第周期第族。氯的最高价氧化物的化学式为,最高价氧化物的水化物的化学式为__________。
(5)物质在下列变化过程中克服的是:①共价键②离子键。(填序号)
HCl溶于水电解熔融NaCl制Na
电解水分解生成O2和H2
(6)在下述反应中,属于取代反应的是;属于氧化反应的是;属于加成反应的是。
①乙烯使溴水褪色②乙烯使酸性高锰酸钾溶液褪色③苯与浓硝酸制硝基
A是一种重要的化工原料,它的产量可以衡量一个国家石油化工水平的高低。A、B、C、D在一定条件下存在如下转化关系(部分反应条件、产物被省略)。
(1)工业上,由石油获得石蜡油的方法是_________,由石蜡油获得A是________变化。
(2)写出A→B的反应方程式:
该反应的类型是____________________
写出反应B+C→D的化学方程式:____________________________
该反应的类型是。
(3)使1molA与氯气发生完全加成反应,然后使该加成反应的产物与氯气在光照的条件下发生完全取代反应,则两个过程中消耗的氯气的总的物质的量是mol
(4)实验室制备D的实验装置图如图所示:收集产物的试管中盛放的液体为;该溶液的作用有:
①除掉产物中的和杂质;
②
(5)在制备乙酸乙酯过程中,往往加入的乙酸和乙醇的量要比理论计算量多得多,请解析其中可能存在的原因:
①
②
下图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:
(1)当电极a为Al、电极b为Cu、电解质溶液为稀硫酸时,写出该原电池的总的离子反应反应方程式:
正极的电极反应式为:
当a极溶解的质量为5.4g时,有mol电子通过导线
(2)当电极a为Al、电极b为Mg、电解质溶液为氢氧化钠溶液时,
该装置(填“能”或“不能”)形成原电池,
若不能,请说明理由(若能该空不作答),
若能,该原电池的正极为;该原电池总的化学反应方程式为:
( 4分)烷基取代苯 R可以被KMnO4的酸性溶液氧化生成
R可以被KMnO4的酸性溶液氧化生成 COOH,但若烷基R中直接与苯环连接的碳原子上没有C一H键,则不容易被氧化得到
COOH,但若烷基R中直接与苯环连接的碳原子上没有C一H键,则不容易被氧化得到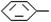 COOH。现有分子式是C11H16的一烷基取代苯,已知它可以被氧化成为
COOH。现有分子式是C11H16的一烷基取代苯,已知它可以被氧化成为 COOH的异构体共有7种,其中的3种是
COOH的异构体共有7种,其中的3种是 CH2CH2CH2CH2CH3,
CH2CH2CH2CH2CH3,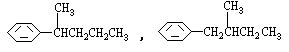
请写出其他4种的结构简式:
_________________、________________、_________________、___________________。