已知25℃时有关弱酸的电离平衡常数:
| 弱酸 |
CH3COOH |
HCN |
H2CO3 |
| 电离平衡常数 |
1.8×l0-5 |
4.9×l0-10 |
K1=4.3×l0-7 K2=5.6×l0-11 |
25℃下,下列有关说法正确的是
A.浓度为0.1mol/L的HCN溶液中c(OH-)=10-13mol/L
B.物质的量浓度相同的稀酸溶液中KW:CH3COOH>H2CO3>HCN
C.物质的量浓度相同的三种钠盐溶液的pH:NaHCO3>NaCN>CH3COONa
D.浓度均为amol•L-1HCN溶液与NaOH溶液等体积混合充分反应后的溶液中(忽略体积的变化)c(H+)<c(OH-)<c(CN-)<0.5amol/L
反应4NH3(气)+5O2(气)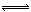 4NO(气)+6H2O(气)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率
4NO(气)+6H2O(气)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率 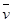 (X)(反应物的消耗速率或产物的生成速率)可表示为
(X)(反应物的消耗速率或产物的生成速率)可表示为
A.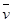 (NH3) =" 0.010" mol/(L·s) (NH3) =" 0.010" mol/(L·s) |
B.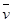 (O2) =" 0.0010" mol/(L·s) (O2) =" 0.0010" mol/(L·s) |
C.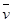 (NO) =" 0.0010" mol/(L·s) (NO) =" 0.0010" mol/(L·s) |
D.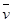 (H2O) =" 0.045" mol/(L·s) (H2O) =" 0.045" mol/(L·s) |
反应A+B C(ΔH>0)分两步进行:① A+B
C(ΔH>0)分两步进行:① A+B X(ΔH<0),② X
X(ΔH<0),② X C(ΔH>0)。下列示意图中,能正确表示总反应过程中能量变化的是
C(ΔH>0)。下列示意图中,能正确表示总反应过程中能量变化的是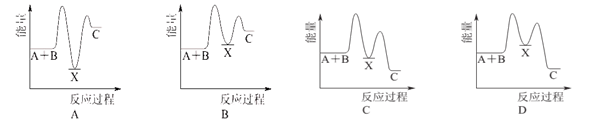
有甲、乙两个装置,下列说法错误的是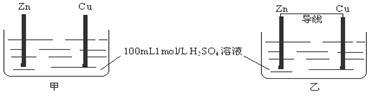
| A.甲、乙装置中,Zn的质量均减小 | B.甲、乙装置中,Cu上均有气泡产生 |
| C.化学反应速率 乙 > 甲 | D.甲中H+ 移向Zn,乙中H+ 移向Cu |
下列热化学方程式正确的是
| A.2SO2+O22SO3;H =-196.6 kJ·mol-1 |
| B.H2 (g)+1/2O2 (g) = H2O(l);H =-285.8 kJ·mol-1 |
| C.2H2 (g)+O2 (g) = 2H2O(l);H =-571.6 kJ |
| D.C(s)+O2 (g) = CO2 (g);H = +393.5 kJ·mol-1 |
下图容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是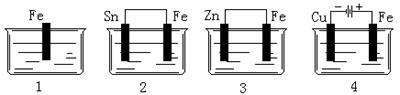
| A.4>2>1>3 | B.2>1>3>4 | C.4>2>3>1 | D.3>2>4>1 |