化合物M是一种治疗心脏病药物的中间体。以A为原料的工业合成路线如下图所示。己知:RONa+R′Cl→ROR′+NaCl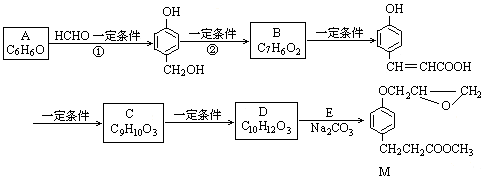
根据题意完成下列填空:
(1)写出反应类型。反应① 反应②
(2)写出结构简式。A C
(3)写出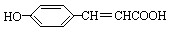 的邻位异构体分子内脱水产物香豆素的结构简式。
的邻位异构体分子内脱水产物香豆素的结构简式。
(4)由C生成D的另一个反应物是 ,反应条件是 。
(5)写出由D生成M 的化学反应方程式。
(6)A也是制备环己醇( )的原料,写出检验A已完全转化为环己醇的方法。
)的原料,写出检验A已完全转化为环己醇的方法。
(1)在密闭容器中进行下列反应:M(g) + N(g) R(g) + 2L(?),此反应规律符合下图图像。
R(g) + 2L(?),此反应规律符合下图图像。
①T1T2,正反应的△H0。(填“>”、“<”或“=”,下同)。
②P1P2 , L为。(填“固”或“液”或“气”态)。
(2)合成氨的原理为:N2(g)+3H2(g)  2NH3(g)
2NH3(g) H=-92.4 kJ/mol,该反应的能量变化如图所示。
H=-92.4 kJ/mol,该反应的能量变化如图所示。
①在反应体系中加入催化剂,反应速率增大,E2的变化是(填“增大”、“减小”或“不变”)。②若在一密闭容器中加入1molN2和3molH2,在一定条件下充分反应,放出的热量92.4kJ.(填“>”、“<”或“=”)。
③将1 mol N2和3 mol H2充入体积不变的密闭容器中,在一定条件下达到平衡,此时欲提高该容器中H2的转化率,下列措施可行的是(填字母)。
| A.向容器中按原比例再充入原料气 | B.向容器中再充入一定量H2 |
| C.改变反应的催化剂 | D.液化生成物分离出氨 |
④若在密闭容器中充入2molN2和6molH2反应达平衡时N2的转化率为40%。若以NH3作为起始反应物,反应条件与上述反应相同时,要使其反应达到平衡时各组分的物质的量分数与前者相同,则NH3的起始物质的量和它的转化率分别为mol、。
(1)已知红磷比白磷稳定,又知:4P(白磷,s)+5O2(g)=2P2O5(s) △H1;
4P(红磷,s)+5O2(g)=2P2O5(s) △H2,则ΔH1和ΔH2的关系是△H1△H2(填“>”、“<”
或“=”)。
(2)已知H2(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1和-726.5kJ·mol-1,写出由CO2
和H2生成液态甲醇和液态水的热化学方程式。
(3)已知一定温度下,下列反应的平衡常数:SO2(g)+1/2O2(g)  SO3(g) K1,CO(g)+1/2O2(g)
SO3(g) K1,CO(g)+1/2O2(g)  CO2(g) K2。则相同温度下反应SO2(g)+CO2(g)
CO2(g) K2。则相同温度下反应SO2(g)+CO2(g)  SO3(g)+CO(g)的平衡常数为。
SO3(g)+CO(g)的平衡常数为。
(用K1、K2表示)
现有0.1mol·L-1的Na2SO4和0.1mol·L-1的H2SO4混合溶液100mL,向其中逐滴加入0.2mol·L-1的Ba(OH)2溶液,并不断搅拌,使反应充分进行。(忽略溶液体积变化)
⑴当加入50mLBa(OH)2溶液时,发生反应的总离子方程式为,所得溶液中的溶质物质的量浓度为mol·L—1(保留小数点后3位数字);
⑵当溶液中沉淀量达到最大时,所加Ba(OH)2溶液的体积为mL,所得溶液溶质物质的量浓度为 mol·L-1。
有一固体混合物,可能由Na2CO3、Na2SO4、FeSO4、CaCl2、NaCl等混合而成,为检验它们,做了以下实验:
① 将固体混合物溶于水中,搅拌后得无色透明溶液;
② 往此溶液中滴加硝酸钡溶液,有白色沉淀产生;
③ 过滤,将沉淀物置于足量稀硝酸中,发现沉淀部分溶解。
根据上述实验事实,回答下列问题:
(1)原固体混合物中一定含有的物质是,一定不含有的物质是,(均填化学式)。对可能含有的物质,可采用向滤液中滴加溶液的方法来检验。
(2)写出步骤③中的离子方程式。
根据反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O回答下列问题:
(1)氧化剂是,氧化产物是。
(2)氧化剂与氧化产物的物质的量比是。
(3)当有2 mol HNO3被还原时,被氧化的物质的质量为,反应中转移的电子数为;
(4)有下列6种物质:K2SO4、K2SO3、I2、H2SO4、KIO3、H2O组成一个氧化还原反应,已知在反应中K2SO3失去电子。请回答下列问题:
将这6种物质分别填入下面对应的横线上,组成一个化学方程式(不需配平):
________+________+________ → ________+________+________