设NA是阿伏加德罗常数的数值,下列说法正确的是
| A.1mol·L-1NaCl溶液含有NA个Na+ |
| B.1molCl2与足量的铁反应,转移的电子数为3NA |
| C.1 mol Na 与足量O2在一定条件下反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
| D.在酸性条件下,1molFe2+ 与足量的H2O2溶液反应,转移2 NA个电子 |
某固体混合物可能由A l、(NH4)2SO4、MgCl2、AlCl3、FeCl2中的一种或几种组成,现对该混合物作如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积),下列说法正确的是()
l、(NH4)2SO4、MgCl2、AlCl3、FeCl2中的一种或几种组成,现对该混合物作如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积),下列说法正确的是()
| A.混合物中一定含有Al、(NH4)2SO4和MgCl2,一定不含AlCl3、FeCl2 |
| B.混合物中一定含有Al、(NH4)2SO4和MgCl2,一定不含FeCl2,不能确定是否含有AlCl3 |
| C.所有物质是否存在均能确定,不存在无法确定的物质 |
| D.混合物中一定含有Al、(NH4)2SO4、MgCl2和AlCl3,一定不含FeCl2 |
今有一混合物的水溶液,可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、
CO32-、SO42-,现取三 份各100mL溶液进行如下实验:
份各100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液无沉淀产生,加热后,收集到气体0.03mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量变为2.33g。
根据上述实验,下列推测正确的是()
| A.依据电荷守恒,推测一定存在K+和NH4+ | B.100mL溶液中含0.01mol CO32- |
| C.Ba2+一定不存在,Mg2+可能存在 | D.2.33g沉淀中含BaCO3和BaSO4 |
维生素E是一种脂溶性维生素,有抗衰老的特殊作用。维生素E有四种类型,其结构简式如图所示[R为(CH2)3CH(CH3)(CH2)3CH(CH3)(CH2)3CH(CH3)2]。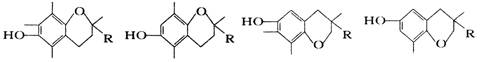
下列说法中,正确的是( )
| A.四种维生素E均能与烧碱溶液反应 | B.四种维生素E均能与溴水反应 |
| C.四种维生素E互为同分异构体 | D.四种维生素E均能在稀硫酸中水解 |
下列实验现象预测正确的是()
| A.实验Ⅰ:振荡后静置,溶液不再分层,且保持无色透明 |
| B.实验Ⅱ:铁片最终完全溶解,且高锰酸钾溶液变无色 |
| C.实验Ⅲ:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色 |
| D.实验Ⅳ:当溶液至红褐色,停止加热,让光束通过体系时可产生丁达尔现象 |
下列实验操作中错误的是()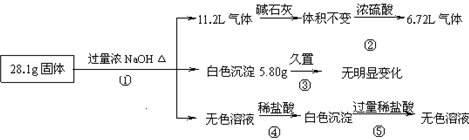
| A.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 |
| C.测pH值时,应用玻璃棒蘸取待测液滴于湿润pH试纸中部,再与标准比色卡对比 |
| D.称量时,称量物放置于托盘天平的左盘,砝码放在托盘天平的右盘 |