电镀厂曾采用有氰电镀工艺,由于排放的废水中含有的剧毒CN-离子,而逐渐被无氰电镀工艺替代。处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成OCN-,再在酸性条件下继续被NaClO氧化成N2和CO2。环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并测定CN-被处理的百分率。将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200mL(其中CN-的浓度为0.05mol·L-1)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。回答下列问题: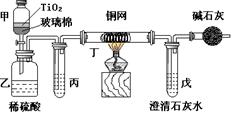
(1)乙中反应的离子方程式为 。
(2)乙中生成的气体除N2和CO2外,还有副产物HCl及Cl2等,上述实验是通过测定二氧化碳的量来确定对CN-的处理效果。则丙中加入的除杂试剂是___________(填字母)
| A.饱和食盐水 | B.饱和NaHCO3溶液 | C.浓NaOH溶液 | D.浓硫酸 |
(3)丁在实验中的作用是 。
装有碱石灰的干燥管的作用是 。
(4)戊中盛有含Ca(OH)2 0.02mol的石灰水,若实验中戊中共生成0.82 g沉淀,则该实验中测得CN-被处理的百分率等于 。若该测得值与实际处理的百分率相比偏低,请简要说明可能的任意一个原因 。
(5)请提出一个能提高准确度的建议(要有可操作性,不宜使操作变得过于复杂) 。
酸碱中和滴定常用于测定酸碱溶液的浓度。
(1)实践中,在正式测定前,常常用已知浓度的酸(或碱)滴定已知浓度的碱(或酸),测定滴定曲线,然后选择合适的指示剂指示滴定终点,以保证数据的准确性。如:用0.100 0 mol/L NaOH溶液滴定20.00 mL 0.100 0 mol/L醋酸(CH3COOH) 溶液,有关数据记录如下表:
| V/(NaOH)/mL |
0.00 |
10.00 |
18.00 |
19.80 |
19.98 |
20.00 |
20.02 |
20.20 |
22.00 |
40.00 |
| 溶液pH |
2.87 |
4.74 |
5.70 |
6.74 |
7.74 |
8.72 |
9.70 |
10.70 |
11.70 |
12.50 |
①根据上表数据绘制0.100 0 mol/L NaOH溶液滴定20.00 mL 0.100 0 mol/L醋酸(HAc)溶液的滴定曲线。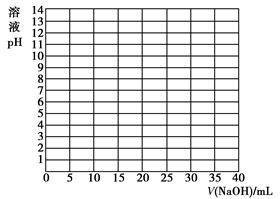
②根据你所绘制的曲线,确定pH的突变范围是________。
③下列指示剂中适合于本实验的是________。(填序号)
A.甲基橙 B.石蕊 C.酚酞
判断到达滴定终点的实验现象
(2)滴定过程中,眼睛应重点观察__。
如下图是常见仪器的部分结构。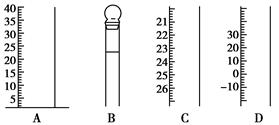
(1)写出仪器名称:A________,B________,C________,
(2)使用前需检查是否漏水的仪器有________。(填序号)
常温下,将HCl溶液和一元碱AOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
| 实验编号 |
HCl物质的量浓度(mol·L-1) |
AOH物质的量浓度(mol·L-1) |
混合溶液的pH |
| 甲 |
0.1 |
0.1 |
pH=a |
| 乙 |
0.1 |
c |
pH=7 |
| 丙 |
0.1 |
0.1 |
pH=5 |
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明AOH是强碱还是弱碱。
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.1________(选填“是”或“否”)。
(3)丙组实验所得溶液中由水电离出的c(OH-)=________mol·L-1。
为了验证Cu和浓H2SO4反应的产物中有SO2和H2O,选用下图所示仪器(内含物质)组装成实验装置: B中有无水硫酸铜、C中有品红溶液、D中有氢氧化钠溶液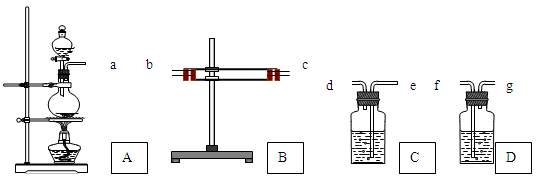
(1) 如按气流由左向右流向,连接上述装置的正确顺序是(填各接口字母):
a接,接,接;
(2) 仪器B、C应有怎样的实验现象才表明已检验出SO2和H2O?
B中,C中;
若将 B、C装置前后对调,对实验有何影响
。
(3) D中氢氧化钠溶液的作用是;
(4) 写出A中反应的化学方程式。
实验室利用图所示装置进行NaHCO3的受热分解实验。请回答: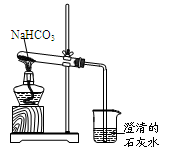
(1)加热一段时间后,烧杯中观察到的实验现象是。
(2)实验结束时的正确操作是(填序号),否则会引起。
①先将导管从液体中移出,再熄灭酒精灯
②先熄灭酒精灯,再将导管从液体中移出
(3)NaHCO3受热分解的化学方程式是。