欲测定某NaOH溶液的物质的量浓度,可用0.1000mol·L-1HCl标准溶液进行中和滴定(用甲基橙作指示剂)。
请回答下列问题:
(1)滴定时,盛装待测NaOH溶液的仪器名称为 ,盛装标准盐酸的仪器名称为 ;滴定至终点的颜色变化为 。
(2)若甲学生在实验过程中,记录滴定前滴定管内液面读数为0.50mL,滴定后液面如图,则此时消耗标准溶液的体积为 。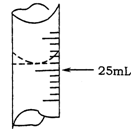
(3)乙学生做了三组平行实验,数据记录如下:
| 实验序号 |
待测NaOH溶液的体积/mL |
0.1000mol·L-1HCl溶液的体积/mL |
|
| 滴定前刻度 |
滴定后刻度 |
||
| 1 |
25.00 |
0.00 |
26.29 |
| 2 |
25.00 |
1.56 |
31.30 |
| 3 |
25.00 |
1.00 |
27.31 |
选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为 (保留四位有效数字)。
(4)下列哪些操作会使测定结果偏高 (填序号)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
制备溴苯的实验装置如右图所示,回答下列问题:
(1)该反应装置中仪器A的名称为。反应开始前已向仪器A中加入的固体药品是铁粉,而装在左侧分液漏斗中的液体药品是。
(2)冷凝管B有上、下两口,冷却水应从口进入
(3)导管口不能插入锥形瓶中的液面之下,其原因是;
(4)右侧分液漏斗中的物质在反应时加入A中(填写反应前、反应中或者反应后)。用离子方程式表达其作用是。
(5)反应结束向锥形瓶中的液体中加入硝酸酸化的硝酸银溶液,可见到现象是。
(6)该过程可以如下表述:3Br2+2Fe=2FeBr3;Br2+FeBr3=FeBr4-+Br+(不稳定); +Br+→[
+Br+→[ ];[
];[ ]+FeBr4-→
]+FeBr4-→ +HBr+FeBr3;
+HBr+FeBr3;
由上反应可知: +Br2→
+Br2→ +HBr中的催化剂为()
+HBr中的催化剂为()
A Fe B FeBr3 C Br+ D FeBr4-
用50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液在如上图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)烧杯间填满碎泡沫塑料的作用是;
(2)环形玻璃搅拌棒能否用环形铁质搅拌棒代替?(填“能”或“不能”),其原因是;
(3)实验时氢氧化钠溶液的浓度要用0.55mol/L的原因是;
实验中若改用60 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液进行反应,与上述实验相比,所放出的热量(填“相等”或“不相等”),若实验操作均正确,则所求中和热(填“相等”或“不相等”);
(4)已知在稀溶液中,强酸和强碱发生中和反应生成1 mol H2O时,放出57.3 kJ的热量,则上述反应的热化学方程式为:。
如图,X和Y均为石墨电极:
(Ⅰ)若电解液为滴有酚酞的饱和食盐水,电解反应的离子方程式为_____________;电解过程中____极(填“阴”或“阳”)附近会出现红色;
(Ⅱ)若电解液为500 mL含A溶质的某蓝色溶液,电解一段时间,观察到X电极表面有红色的固态物质生成,Y电极有无色气体生成;溶液中原有溶质完全电解后,停止电解,取出X电极,洗涤、干燥、称量,电极增重1.6 g。
(1)电解后溶液的pH为___;要使电解后溶液恢复到电解前的状态,需加入一定量的____(填加入物质的化学式)。(假设电解前后溶液的体积不变)
(2)请你推测原溶液中所含的酸根离子可能是____;并设计实验验证你的推测,写出实验的操作步骤、现象和结论:
使用酸碱中和滴定法测定市售白醋的总酸量(g/100 mL)。
Ⅰ.实验步骤:
(1)配制100 mL待测白醋溶液。量取10.00 mL市售白醋,注入烧杯中用水稀释后转移到(填仪器名称)中定容,摇匀即得。
(2)用量取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2_____作指示剂。
(3)读取盛装0.100 0 mol·L-1 NaOH溶液的(填仪器名称)的初始读数。如果液面位置下图所示,则此时的读数为mL。
(4)滴定。滴定过程中,眼睛应观察。滴定终点后记录NaOH溶液的终点读数。再重复滴定3次。
Ⅱ.实验记录:
| 滴定次数 实验数据/mL |
1 |
2 |
3 |
4 |
| V(样品) |
20.00 |
20.00 |
20.00 |
20.00 |
| V(NaOH)(消耗) |
15.95 |
15.00 |
15.05 |
14.95 |
Ⅲ.数据处理与讨论:
(1)甲同学在处理数据时计算得:
平均消耗的NaOH溶液的体积V=[(15.95+15.00+15.05+14.95)/4] mL=15.24mL。
指出他的计算的不合理之处:______________________________________。
按正确数据处理,可得c(市售白醋)=___________mol·L-1;市售白醋总酸量=_________g/100 mL。
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是_______ (填写序号)。
a.未用标准NaOH溶液润洗滴定管
b.锥形瓶中加入待测白醋溶液后,再加少量水
c.锥形瓶在滴定时剧烈摇动,有少量液体溅出
d.滴定前锥形瓶用待测白醋溶液润洗
限使用下列试剂:酚酞溶液、石蕊试液、稀氨水、氯化铵晶体、浓盐酸、熟石灰粉末、醋酸铵晶体和蒸馏水。根据(1)弱碱在水中存在电离平衡;(2)弱碱的阳离子会破坏水的电离平衡。这两种平衡移动均会引起指示剂颜色变化。由此可分别选用上述试剂,设计两个实验证明NH3·H2O是弱碱。请简述实验方法及现象。
(1)应用根据(1)的实验方法及现象
(2)应用根据(2)的实验方法及现象