工业上可以在恒容密闭容器中采用下列反应制备甲醇:
CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
(1)下列情况可以作为判断反应达到平衡状态的依据的是(填序号) 。
A.生成CH3OH 的速率与消耗H2的速率之比为1︰2
B.混合气体的平均相对分子质量保持不变
C.混合气体的密度保持不变
D.体系内的压强保持不变
(2)下表所列数据为该反应在不同温度下的化学平衡常数:
| 温度/℃ |
250 |
300 |
350 |
| K |
2.041 |
0.270 |
0.012 |
①反应的平衡常数表达式为K= 。由上表数据判断,该反应的△H 0(填“>”、“=”或“<”)。升高温度,正反应速率 (填“增大”、“减小”或“不变”)。
②某温度下,将2molCO和6molH2充入一个容积为2L的密闭容器中,达到平衡时c(H2)=1.4mol/L,则CO的转化率为 ,此时的温度为 。
(3)欲提高CO的转化率,可采取的措施是 。(填序号)
A.升温
B.加入更高效的催化剂
C.恒容条件下充入CO
D.恒容条件下充入H2
E.恒容条件下充入氦气
F.及时移走CH3OH
(4)一定条件下,CO和H2在催化剂作用下生成1molCH3OH的能量变化为90.8kJ。该温度下,在三个容积相同的密闭容器中,按不同方式投料,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 |
甲 |
乙 |
丙 |
|
| 投料方式 |
1molCO、2molH2 |
1molCH3OH |
2molCH3OH |
|
| 平衡数据 |
C(CH3OH)/(mol/L) |
c1 |
c2 |
c3 |
| 体系压强(Pa) |
p1 |
p2 |
p3 |
|
| 反应的能量变化 |
akJ |
bkJ |
ckJ |
|
| 原料转化率 |
α1 |
α2 |
α3 |
下列分析正确的是 。(填序号)
A.2c1<c3 B.2 p1<p3 C.|a|+|b|=90.8 D.α1+α3>1
J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素。
(1)M的离子结构示意图为_____;元素T在周期表中位于第_____周期第_____族。
(2)J和氢组成的化合物分子有6个原子,其结构简式为。
(3)M和T形成的化合物在潮湿的空气中冒白色烟雾,反应的化学方程式为。
已知有以下物质相互转化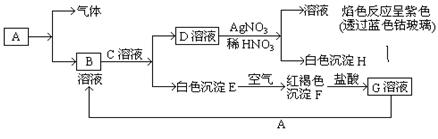
试回答:(1)写出B的化学式D的化学式。
(2)写出由E转变成F的化学方程式。
(3)写出用KSCN鉴别G溶液的离子方程式;
向G溶液加入A的有关离子反应方程式。
| J |
||||
| R |
过硫酸钾(K2S2O8)的氧化性强于KMnO4,某反应在银离子催化下可发生,该反应体系中的物质有:K2S2O8、、KMnO4、K2SO4 、 MnSO4、H2SO4、 H2O。
(1)请写出并配平上述反应的化学方程式:
(2)反应中被还原的物质是:;还原剂是:。
(6分)按要求写热化学方程式:
(1)已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式__________________
(2)25℃、101 kPa条件下充分燃烧一定量的丁烷气体放出热量为Q kJ,经测定,将生成的CO2通入足量澄清石灰水中产生25 g白色沉淀,写出表示丁烷燃烧热的热化学方程式_________________________
离子化合物M(化学式为NaN3)在汽车安全气囊中有重要的作用,M与其他物质的转化关系如下图所示。已知:常温下G为淡黄色固体,H为一种常见的液体,A、B、C、X为单质,其中A、C、X为气体,A、X分别为空气的主要成分之一。I、J为常见的工业原料。相关转化关系如图所示:☆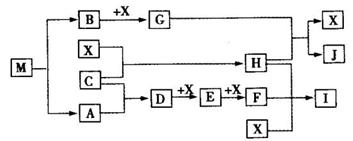
(1)实验室中物质I应如何保存?。
(2)写出D与X反应的化学方程式。
(3)G,F均能氧化SO2 ,若前一反应仅生成一种盐,后一反应生成两种氧化物,写出相应化学方程式;。
(4)常温下M受撞击时可分解,13gM完全分解为A和B时,放出a kJ的热量,写出M分解的热化学方程式。
(5)M是一种易溶于水的盐,其水溶液显弱碱性,用离子方程式解释原因。
(6)相同条件下,等体积等物质的量浓度的M溶液和NaCl溶液中,阴、阳离子总数的关系是前者后者.(填大于、等于或小于)