现有失去标签的CaCl2、AgNO3、HCl、和Na2CO3四瓶溶液。为了确定四种溶液的成分,将它们编号为A、B、C、D后进行化学实验。实验记录如下:
| 实验顺序 |
实验内容 |
实验现象 |
| ① |
A + B |
无明显现象 |
| ② |
B + D |
有无色无味气体放出 |
| ③ |
C + B |
有白色沉淀生成 |
| ④ |
A + D |
有白色沉淀生成 |
根据上述实验完成下列各小题:
(1)A、B、C、D四瓶溶液分别是(用化学式表示所含溶质)
A B C D
(2)写出B与D反应的离子方程式
写出B与C反应的离子方程式
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ·mol-1表示。请认真观察右图,然后回答问题。
(1)图中所示反应是_________(填“吸热”或“放热”)反应,该反应_____________(填“需要”或“不需要”)加热,该反应的△H =_________________(用含E1、E2的代数式表示)。
(2)已知热化学方程式:H2(g)+ O2(g) = H2O(g) △H =-241.8 kJ·mol-1,该反应的活化能为167.2 kJ·mol-1,则其逆反应的活化能为____________________。
H2O(g) △H =-241.8 kJ·mol-1,该反应的活化能为167.2 kJ·mol-1,则其逆反应的活化能为____________________。
为了探究原电池的电极名称不仅与电极材料有关还与电解质溶液有关,某学生做了如下的实验
| 编号 |
电极材料 |
电解质溶液 |
电子流向 |
| ① |
Mg—Al |
HNO3(浓) |
Mg→Al |
| ② |
Mg—Al |
HCl(aq) |
Mg→Al |
| ③ |
Mg—Al |
NaOH(aq) |
Al→Mg |
| ④ |
Al—Cu |
HNO3(浓) |
Cu→Al |
根据以上表格内容回答:
(1)实验1中Mg作___________(填正极或负极),发生__________(氧化反应或还原反应)
实验3中Mg作___________,发生__________(同上)
(2)实验2中Mg电极反应式为__________________。Al电极上的电极反应式为_________________________,总的电池反应是______________________________。
一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图,依图所示: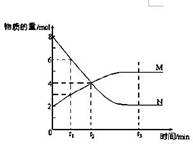
(1)该反应的化学方程式是___________________。
(2)在图上所示的三个时刻中,(填t1、t2或t3)时刻处于平衡状态,此时V正V逆(填>、<或=);达到平衡状态后,平均反应速率v(N)﹕v(M)= 。
(3)若反应容器的容积不变,则压强不再改变(填“能”或“不能”)作为该反应已达到平衡状态的判断依据。
(4)已知M、N均为气体,则下列措施能增大反应速率
| A.升高温度 | B.降低压强 | C.减小M的浓度 | D.将反应容器体积缩小 |
有机化学中常用18O原子作示踪原子来研究乙酸与乙醇反应生成酯的反应机理,反应过程中酸分子断裂C—O单键,醇分子断裂O—H键。试述书写CH3COOH和CH3CH218OH反应的化学方程式:
已知反应: KClO3 + 6HCl =" KCl" + 3Cl2 + 3H2O ,若用K35ClO3与H37Cl作用,则所得氯气的相对分子质量为 .
A、B、C、D、E都为短周期元素,A是相对原子质量最小的元素;B的+1价阳离子和C的―1价阴离子都与氖原子具有相同的电子层结构;D在C的下一周期,可与B形成BD型离子化合物;E和C为同一周期元素,其最高价氧化物对应的水化物为一种强酸。请根据以上信息回答下列问题。
(1)B元素在元素周期表中的位置是第______周期______族。
(2)画出D元素的原子结构示意图____________。
(3)与E的氢化物分子所含电子总数相等的分子是____________(举一例、填化学式,下同)、离子是____________。
(4)A与C形成的化合物中含有化学键的类型是____________。
(5)D的单质与B的最高价氧化物对应的水化物的溶液发生反应的离子方程式为____________________。