(一)(4分)括号中的物质是杂质,写出除去这些杂质的试剂:
(1)MgO (Al2O3) (2)Cl2(HCl)
(3)FeCl3(FeCl2) (4)NaHCO3溶液(Na2CO3)
(二)(6分)海水中含有大量的氯化镁,从海水中提取镁的生产流程如下图所示:
回答下列问题:
写出在海水中加入氧化钙生成氢氧化镁的化学方程式 ;
操作①主要是指 ;试剂①可选用 ;
操作②是指 ;经操作③最终可得金属镁。
(三)实验室配制480ml 0.1mol·L-1的Na2CO3溶液,回答下列问题:
(1)应用托盘天平称取十水碳酸钠晶体 g。
(2)如图所示的仪器配制溶液肯定不需要的是 (填序号),本实验所需玻璃仪器E规格为 mL。
(3)容量瓶上标有:①温度、②浓度、③容量、④压强、⑤刻度线、⑥酸式或碱式这六项中的 。(填数字符号)
(4)配制所需的主要仪器是:a容量瓶、b烧杯、c胶头滴管、d托盘天平,它们在操作过程中使用的前后顺序是 。(填写字母,每种仪器只能选择一次)
(5)玻璃棒是化学实验中常用的一种玻璃工具,则在配制溶液的过程中玻璃棒共起到了 种用途。(填写数字)
(6)若实验时遇到下列情况,将使溶液的浓度偏低的是 。
| A.配制前没有将容量瓶中的水除尽; |
| B.碳酸钠失去了部分结晶水; |
| C.碳酸钠晶体不纯,其中混有氯化钠; |
| D.称量碳酸钠晶体时所用砝码生锈; |
E.定容时仰视刻度线
为测定放置已久的小苏打样品中纯碱的质量分数,设计如下实验方案:
(1)方案一:称取一定质量的样品,置于坩埚中加热至恒重后,冷却,称取剩余固体质量,计算。实验中加热至恒重的目的是。
(2)方案二:按下图装置进行实验。并回答以下问题。
①实验前先_______________。分液漏斗中应该装_____(盐酸或硫酸)。D装置的作用是。
②实验中除称量样品质量外,还需称___________装置前后质量的变化。
③根据此实验得到的数据,测定结果有误差。因为实验装置还存在一个明显缺陷,该缺陷是。
(3)方案三:称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量氯化钡溶液。过滤、洗涤,干燥沉淀,称量固体质量,计算:
①过滤操作中,除了烧杯外还用到的玻璃仪器有_______________;
②实验中判断沉淀是否完全的方法是。
③如加入试剂改为氢氧化钡,已知称得样品9.5g,干燥的沉淀质量为19.7g,则样品中碳酸钠的质量分数为____________(计算结果保留两位有效数字)。
(8分)有一乡村中学由于条件有限,仅有一大一小两种试管和稀硫酸。甲、乙两个学生找来铝或废牙膏皮,各自设计了一种装置,制取并收集一试管氢气。(如图)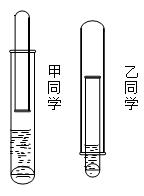
(1)哪个学生设计的装置比较合理?。另一个装置不合理的原因(至少说出一个原因)。
(2)用较合理的装置制取氢气,要使氢气充满收集氢气的试管,应该采取的措施是。
(3)还可以用哪些物品代替牙膏皮和稀硫酸完成制取氢气的实验?
。
已知乙二酸(HOOC―COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,其熔点为101.5℃,在157℃升华。某校研究性学习小组为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1 mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生。该反应的离子方程式为_________________________________________________。
(2)向盛有少量乙二酸饱和溶液的试管中滴入用硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去,说明乙二酸具有_________________(填“氧化性”、“还原性”或“酸性”),请配平该反应的离子方程式:
____ MnO4– + ____ H2C2O4 + _____ H+ =" _____" Mn2+ + _____ CO2↑ + _____ H2O
(3)将一定量的乙二酸放于试管中,按下图所示装置进行实验(夹持装置未标出):
实验发现,装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末变红,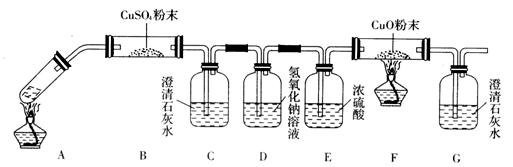
据此,乙二酸分解的产物为______________________。上述装置中,D的作用是______。装置F中发生反应的化学方程式为: _________________________________________。
(4)该小组同学将2.52g草酸晶体(H2C2O4•2H2O)加入到100 mL 0.2 mol/L的NaOH溶液中充分反应,测得反应后溶液呈酸性,其原因是_________________________________。
某学习小组从海带中提取I2,实验步骤如下:
(1)实验室焙烧海带,需要下列仪器中的____________
a.试管 b.烧杯 c.坩埚 d.泥三角 e.铁三角架 f.酒精灯
(2)将所得海带灰加水溶解、过滤,所需玻璃仪器有_______________________________
(3)在滤液中检出了I-,还检出了K+,检验K+的操作步骤是_______________________。
(4)经查阅资料,得知氧化性由强到弱的顺序为:Cl2 > IO3- > H2O2 > I2,他们决定用H2O2做氧化剂氧化KI,而不用Cl2,原因可能是____________________________。
(5)小组用CCl4萃取碘水中的碘,在如图的分液漏斗中,下层液体呈_______色;打开分液漏斗活塞,却未见液体流下,原因可能是___________。
(6)根据以下数据推测:
①已知SiCl4的沸点是57.6℃,则CCl4的沸点_________(填“高”或“低”)于57.6℃
②已知I2的沸点是113.6℃,熔点是185.2℃,从碘的CCl4溶液中分离出碘单质,应采取的方法是___________。
| A.过滤 | B.升华 | C.蒸发 | D.蒸馏 |
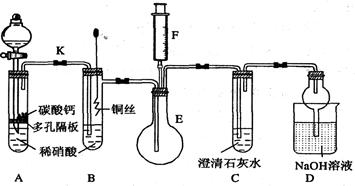
某课外活动小组为了验证铜与稀硝酸反应产生的气体是NO而设计了下列实验,装置如图所示(加热装置和固定装置均已略去)。图中K为止水夹,F是装有一半空气的注射器。
17.
18.请回答有关问题:
19.(1)设计装置A的目的是,如何判断已完成该目的__________________
20.(2)在完成(1)中的“操作”后,将装置B中铜丝插入稀硝酸,并微热之,观察到装置B中的现象是 ;B中反应的离子方程式为:。
21.(3)装置E和F的作用是;为实现此作用,其操作方法是。
22.(4)装置D的作用是。