肼(N2H4)是火箭发动机的一种燃料,反应时N2O4为氧化剂,生成N2和水蒸气。已知:
N2(g)+2O2(g)=N2O4(g) ΔH="+8.7" kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH="-534.0" kJ·mol-1
下列表示肼跟N2O4反应的热化学方程式,正确的是
| A.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH="-542.7" kJ·mol-1 |
| B.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH="-1059.3" kJ·mol-1 |
C.N2H4(g)+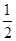 N2O4(g)= N2O4(g)=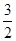 N2(g)+2H2O(g) ΔH="-1076.7" kJ·mol-1 N2(g)+2H2O(g) ΔH="-1076.7" kJ·mol-1 |
| D.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH="-1076.7" kJ·mol-1 |
下列对化学反应的认识错误的是
| A.会引起化学键的变化 | B.会产生新的物质 |
| C.必然引起物质状态的变化 | D.必然伴随着能量的变化 |
配制一定物质的量浓度的氢氧化钠溶液,作为测定盐酸浓度的标准溶液,由于以下操作,会造成所测得盐酸浓度偏低的是( )
| A.取用已部分潮解的烧碱进行称量 |
| B.称量时砝码放在左盘,并动用游码 |
| C.定容结束时,溶液液面的最高点与刻度处于同一水平面上 |
| D.向容量瓶一次转移氢氧化钠溶液,然后向容量瓶加水至所要的体积 |
下列事故处理不正确的是( )
| A.金属钠失火可用泡沫灭火器灭火。 |
| B.酒精灯不慎碰翻着火,可用湿抹布盖灭。 |
| C.不慎将浓硫酸沾在皮肤上,立即用水冲洗。 |
| D.苯酚沾在手上,应立即用酒精冲洗。 |
下列溶液中,在空气中既不易被氧化,也不易分解,且可以用无色玻璃试剂瓶存放的是( )
| A.石炭酸 | B.氢硫酸 | C.氢氟酸 | D.醋酸 |
为了除去蛋白质溶液中混入的少量氯化钠,可以采用的方法是( )
| A.过滤 | B.电泳 |
| C.渗析 | D.加入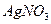 溶液过滤 溶液过滤 |