卡巴拉丁是一种重要的药物,用于治疗轻、中度阿尔茨海默型痴呆症。以下是卡巴拉丁的合成路线:
请回答下列问题:
(1)A分子中含氧官能团的名称为: 、 。
(2)由B生成C的反应类型为: 。D的结构简式为: 。
(3)实现E→卡巴拉丁的转化中,加入化合物X(C4H8NOCl)的结构简式为 。
(4)写出符合下列条件的A的一种同分异构体的结构简式: 。
①能发生银镜反应;
②能水解且产物之一与氯化铁溶液发生显色反应;
③含有四种不同化学环境的氢。
(5)写出由氯甲基苯( )和丙酮(
)和丙酮( )制备化合物
)制备化合物 的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
(12分)化合物A是一种重要的光化学试剂。A~H之间相互转化关系如下图所示:(部分反应物、生成物没有列出)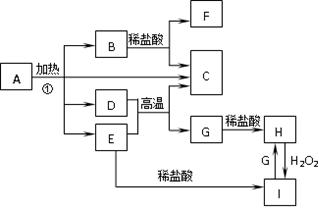
已知:化合物A中含二种阳离子和一种带二个单位负电荷的阴离子,三种离子的个数比为3∶1∶3。阴离子中各元素的质量分数与C相同且相对分子质量是C的2倍。C、D都为气体且含有元素种类相同,C能使澄清石灰水变浑浊,E是一种红棕色的颜料,F的焰色反应呈紫色,I能使KSCN溶液显红色。
回答下列问题:
(1)C的电子式为:;A的化学式为:。
(2)D+E→C+G的化学方程式:。
(3)H+H2O2+HCl→I的离子方程式:。
(4)在A的溶液中滴入酸性高锰酸钾溶液,高锰酸钾溶液紫色褪去,而在A的溶液中滴入硫氰化钾溶液,溶液呈红色。产生上述现象的主要原因是
_________________________________________________________________________。
(18分)下表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素。
| A |
B |
||||||
| D |
E |
F |
|||||
| C |
G |
H |
(1)C的原子结构示意图为:__________________;
(2)A与G形成的化合物X的结构式为____________,其中X中含有的化学键是________
X属于_________化合物(填“离子”或“共价”)。
(3)比较非金属性强弱:G _____ H(填“>”或“<”),用一个化学方程式表示该强弱关系_____________________________________________________________________。
(4)在一定条件下,A与E可形成一种化合物X,其相对分子质量与O2相同,则X为______; X可在纯氧中燃烧,所得产物无污染,涉及的化学方程式为:_____________________。
(5)“神舟”六号载人飞船内需要用化合物X(由上表中的某2种元素组成)来吸收航天员呼出的CO2,请用化学方程式表示吸收原理:_______________________________。飞船中需要制造一种适合航天员生存的人工态环境,还应该在氧气中充入一种稀释气体,该气体为_______。
(6)E的气态氢化物与其最高价氧化物水化物反应的产物X在一定温度下分解,生成两种氧化物,每1 mol X分解时转移的电子为4 mol,X受热分解的化学方程式为_______
(12分)化学与人类社会可持续发展密切相关,能源、环境、材料以及日常生活等都离不开化学。
(1)乐山是国家级硅材料产业基地,硅材料是无机非金属材料的主角。请你举出两种含硅的材料名称 、 。用氢气在高温下还原SiCl4是高纯硅生产过程中的一个环节,写出该反应的化学方程式 。
(2)大量使用化石燃料,最直接的危害是造成“温室效应”、“酸雨”等环境问题。为了防治酸雨,降低煤燃烧时向大气排放的SO2,某硫酸工厂上使用石灰乳吸收尾气,涉及的化学方程式为:
(3)汽车尾气中的NO、CO已经成为许多城市空气的主要污染源。但汽车的燃料中一般不含氮元素,尾气中的NO从何而来?写出有关化学方程式;治理汽车尾气中NO和CO的一种方法是:在汽车排气管上装一个催化转化装置,使NO与CO反应,生成CO2和N2,写出反应的化学方程式。
电解原理在化学工业中有广泛应用。如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
① Y电极上的电极反应式为。
在X极附近观察到的现象是。
②电解总反应离子方程式为。
(2)要在铁件的表面镀铜防止铁被腐蚀,则:
① Y电极的材料是(选填纯铁、纯铜或纯锌),电极反应式是。电解液a选用溶液,电解过程中其浓度(选填增大、减小或不变)。
②若电镀前X、Y两电极的质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12 g,则电镀时电路中通过的电子为mol。
③镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因:
。
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示。请认真观察下图,然后回答问题:
(1)图中所示反应是_____________(填“吸热”或“放热”)反应,该反应的△H=____________ kJ·mol-1(用含E1、E2的代数式表示)。
(2)已知热化学方程式:H2(g)+1/2O2(g)=H2O(g)△H=-241.8kJ·mol-1。该反应的活化能为167.2kJ·mol-1,则其逆反应的活化能为kJ·mol-1。
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率明显加快,你认为最可能的原因是。