氮元素可以形成多种化合物。回答以下问题:
(1)基态氮原子的价电子排布式是 。
(2)C、N、O三种元素第一电离能从大到小的顺序是 。
(3)(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮的氢化物。
①N2H4分子中氮原子轨道的杂化类型是 。
②肼可用作火箭燃料,燃烧时发生的反应是:N2O4(1)+2N2H4(l)=3N2(g)+4H2O(g)△H=" —103" 8.7kJ.mol—1
若该反应中有4mol N—H键断裂,则形成的 键有 mol。
键有 mol。
③肼能与硫酸反应生成N2H6SO4,N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在 (填标号)
a.离子键 b.共价键 c.配位键 d.范德华力
(4)氮化硼(BN)是一种重要的功能陶瓷材料,在与石墨结构相似的六方氮化硼晶钵中,层内B原子与N原子之间的化学键为___ 。
(5)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为3.615×l0—10m,立方氮化硼晶胞中含有 个氮原子、 个硼原子,立方氮化硼的密度是 g.cm一3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)
镁是“国防金属”,从海水中提取镁通常要经历三大步骤见下图:
请回答下列问题:
(1)步骤1是提高海水中Mg2+浓度,方法是。
(2)步骤2的离子方程式为。
已知Mg(OH)2的Ksp=5.61×10-12,假设浓缩海水中MgCI2浓度为3mo1/L,则要使Mg2+形成Mg( OH )2沉淀,则加入沉淀剂后海水中的OH-浓度至少要达到。
工业生产为了获得更高的利润,根据表1分析,最合理的沉淀剂是_,生产这种沉淀剂的方法是。
表1试剂价格
| 试剂 |
KOH |
NaOH |
Ca(OH)2 |
| 价格(元/吨) |
6800 |
3200 |
1200 |
(3)步骤3如何实现?两位同学设计下列方案: 
这两种方案是否合理?请你评价:
方案一:。
方案二:。
你的设计方案是什么?写出流程图:
。
甲醇是一种很好的燃料,工业上用CH4和H2O 为原料,通过反应I和Ⅱ来制备甲醇。
⑴将1.0 mol CH4和2.0 mol H2O(g)通人反应室(容积为100L),在一定条件下发生反应:
CH4(g)+H2O(g) CO(g)+3H2(g)……I。CH4的转化率与温度、压强的关系如右图所示。
CO(g)+3H2(g)……I。CH4的转化率与温度、压强的关系如右图所示。
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为。
②图中的P1_P2(填“<”、“>”或“=”),100℃时平衡常数为。
③该反应的△H0(填“<”、“>”或“=”)。
(2)在一定条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇: CO(g)+2H2(g) CH3OH(g)△H<0……Ⅱ
CH3OH(g)△H<0……Ⅱ
④若容器容积不变,下列措施可增加甲醇产率的是
A.升高温度 B.将CH3OH(g)从体系中分离
C.充人He,使体系总压强增大 D.再充人lmol CO和3 mol H2
⑤为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
A.下表中剩余的实验条件数据: a=_;b=_。
| 实验编号 |
T(℃) |
n(CO)/n(H2) |
P(Mpa) |
| 1 |
150 |
1/3 |
0.1 |
| 2 |
a |
1/3 |
5 |
| 3 |
350 |
b |
5 |
B.根据反应Ⅱ的特点,右下图是在压强分别为0.1 MPa和5MPa下CO的转化率随温度变化的曲线图,请指明图中的压强Px = Mpa。
化合物A为一种常见金属元素与一种常见非金属元素组成的化合物,阳离子与阴离子的个数比为2:3。K为常见固态非金属单质,J、N为常见气态单质,其余为化合物,其中I、F在常温下为液态,C、D为刺激性气体,H无色无味气体,B为白色胶状沉淀,L为氯碱工业中的常见产品。F的浓溶液与K加热可生成D和H。(部分生成物未标出)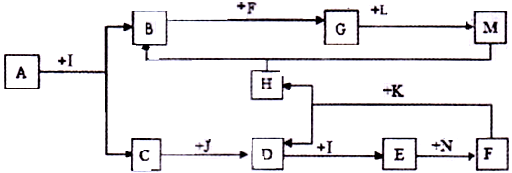
(1)H的结构式为:;B的化学式为:。
(2)写出下列变化的化学方程式:
A+I →B+C:。
F的浓溶液与K加热可生成D和H:。
(3)写出下列变化的离子方程式:
N通入E的水溶液:。
M的水溶液中通人过量的H:。
(4)在A~K所有物质中属于弱电解质的是_,属于非电解质的是(用编号回答)。
相对分子质量为162的有机化合物M,用于调制食用香精,分子中碳、氢原子数相等,且为氧原子数5倍,分子中只含有一个苯环且苯环上只有一个取代基。芳香烃A的核磁共振氢谱谱图有6个峰,其面积之比为1:2:2:2:1:2。用芳香烃A为原料合成M 路线如下:
巳知:
试回答下列问题:
(1)A的结构简式__________,F中的官能团名称是_____。
(2)试剂X的名称_____。
(3)B-C的反应类型是_____,F—G的反应类型是_____。
(4) 完成下列化学方程式
F→I:__________。
G→M:__________。
(5)其中F的同分异构体有多种,其中有一类可用通式如图 表示(其中X、Y均不为氢原子),试写出符合上述通式且能发生银镜反应的两种物质的结构简式__________。
表示(其中X、Y均不为氢原子),试写出符合上述通式且能发生银镜反应的两种物质的结构简式__________。
卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1)卤素互化物如IBr ICl等与卤素单质结构相似、性质相近。Cl2、IBr、ICl沸点由髙到低的顺序为
_____,I和Cl相比,电负性较大的是_____。
(2)基态溴原子的电子排布式为_____,碘原子价电子的电子排布图为_____。
(3)I3+属于多卤素阳离子,根据VSEPR模型推测I3+的空间构型为______,中心I原子的杂化轨道类型为
__________。
(4)请推测①HClO4、②HIO4、③H5IO6[可写成(HO)5IO]三种物质的酸性由强到弱的顺序为_______(填序号)。
(5) 离子化合物RbICl2存在复合阴离子,且晶体结构与NaCl相似,晶胞边长为685.5pm( pm=10-12m), RbICl2晶胞中含有______个氯原子,RbICl2晶体的密度是_____g•cm3(只要求列箅式,不必计算出数值。阿伏伽德罗常数为NA)。