(1)已知:2NO2(g) N2O4(g);△H<0。在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。
N2O4(g);△H<0。在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。
①a、b、c、d四个点中,表示化学反应处于平衡状态的点是 。
②前10 min内用NO2表示的化学反应速率v(NO2)= mol·L-1·min-1。反应在第一个平衡点的平衡常数K(1)= (可用分数表示)。反应在第二个平衡点的平衡常数K(2)与第一个平衡点的平衡常数K(1)的关系:K(2) K(1)(填“>”、“=”或“<”)。
③请在右图坐标中画出1 mol N2O4通入2L的密闭容器中反应发生过程中的能量变化示意图,并在虚线上分别标出反应物和生成物的化学式。
(2)右图中a、b、c、d分别代表氧族元素(ⅥA族):Te(碲)、Se(硒)、S、O氢化物的反应热的数据示意图。试回答下列问题:
①请你归纳:非金属元素氢化物的稳定性与形成氢化物的反应热△H的关系 。
②写出硒化氢发生分解反应的热化学反应方程式: 。
下列化合物:①HCl、②NaOH、③CH3COOH、④NH3•H2O、⑤CH3COONa、⑥NH4Cl
(1)属于弱电解质的是 ,溶液呈碱性的有 (填序号).
(2)常温下0.01mol/L HCl溶液的pH= ;pH=11的CH3COONa溶液中由水电离产生的c(OH﹣)= .
(3)将等pH等体积的HCl和CH3COOH分别稀释m倍和n倍,稀释后两溶液的pH仍相等,则m n (填“大于、等于、小于”).
(4)常温下,向100mL 0.01mol•L﹣1HA溶液逐滴加入0.02mol•L﹣1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题:
①N点对应的溶液中,c(M+) c(A﹣)(填“大于、等于、小于”).
②K点对应的溶液中,c(M+)+c(MOH)= mol•L﹣1.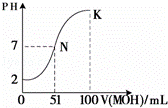
现有常温下的六份溶液:
①0.01mol • L﹣1 CH3COOH溶液;
②0.01mol • L﹣1 HCl溶液;③pH=12的氨水;④ pH=12的NaOH溶液;
⑤0.01mol • L﹣1 CH3COOH溶液与pH=12的氨水等体积混合后所得溶液;
⑥0.01mol • L﹣1 HCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
(1)其中水的电离程度最大的是________(填序号,下同),水的电离程度相同的是________。
(2)若将②③混合后所得溶液的pH=7,则消耗溶液的体积:②________③(填“>”“<”或“=“)。
(3)将六份溶液同等稀释10倍后,溶液的pH:①________②,③________④,⑤______⑥(填“>”“<”或“=“)。
(4)将①④混合,若有c(CH3COO-)>c(H+),则混合溶液可能呈________(填序号)。
A.酸性 B.碱性 C.中性
(1)PH=10的Na2CO3溶液、NaOH溶液和PH=4的NH4Cl溶液、HCl溶液中水的电离程度的大小关系是 。(用化学式表示)
(2)对于Ag2S(s)  2Ag+(aq)+ S2-(aq),其Ksp=____________。
2Ag+(aq)+ S2-(aq),其Ksp=____________。
(3)NH4HSO4的电离方程式为
目前,市场上经常用甲醇碱性燃料电池做为手机的电池,该电池的储电量可长达一个月,非常适合通话量比较高的人群,请写出该燃料电池的正极电极反应: 和负极电极反应: 。
(1)某校学生用中和滴定法测定某NaOH溶液的物质的量浓度。
①盛装0.2000 mol/L盐酸标准液应选用的滴定管是_________(填字母序号)。
②当接近滴定终点时,很少量的碱或酸就会引起溶液的 突变。
③有关数据记录如下:
| 实验编号 |
待测液体积(mL) |
所消耗盐酸标准液的体积(mL) |
|
| 滴定前 |
滴定后 |
||
| I |
20.00 |
0.50 |
20.70 |
| II |
20.00 |
6.00 |
26.00 |
| III |
20.00 |
1.40 |
21.20 |
根据数据计算NaOH溶液的物质的量浓度是______________mol/L。
④若只用蒸馏水冲洗锥形瓶,则测定结果_________(填“无影响”.“偏高”或“偏低”)。
(2)25℃,将一元酸HA溶液和NaOH的溶液等体积混合,两种溶液的浓度和混合后溶液的pH见下表:
| 实验编号 |
c(HA)/mol﹒L-1 |
c(NaOH)/mol﹒L-1 |
混合溶液的pH |
| I |
0.2 |
0.2 |
pH=a |
| II |
c1 |
0.2 |
pH=7 |
| III |
0.2 |
0.1 |
pH>7 |
| IV |
0.1 |
0.1 |
pH=9 |
请回答:
①不考虑其它组实验结果,单从I组实验情况分析,若a_____7(填“>”“<”或“=”),则HA为强酸。
②在II组实验的混合溶液中,c(A-)______ c(Na+)(填“>”“<”或“=”)。
③不考虑其它组实验结果,单从III组实验情况分析,HA是_____酸(填“强”或“弱”);用离子方程式表示混合溶液中存在的两种平衡:_________________,____________________。
④IV组实验的混合溶液中,由水电离出的c (OH-)=___________。