二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,而且与Cl2相比不会产生对人体有潜在危害的有机氯代物。制备ClO2有下列两种方法:
方法一:2 NaClO3+4 HCl=2 ClO2↑+Cl2↑+2 NaCl+2 H2O
方法二:2 NaClO3+H2O2+H2SO4=2 ClO2↑+O2↑+2 Na2SO4+2 H2O
(1)方法一的离子方程式为 .
(2)方法二中被氧化的物质是 ,若反应中有0.1mol电子转移,则产生的ClO2气体在标准状况下的体积为 L.
(3)用方法二制备的ClO2更适合用于饮用水的消毒,其主要原因是 。
下列各组中,属于同分异构体的是______;肯定属于同系物的是______; (填编号)
①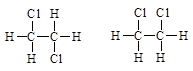
②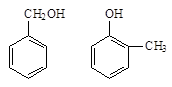
③C3H6与C4H8
④CH3OH与C5H11OH
请同学们根据官能团的不同对下列有机物进行分类。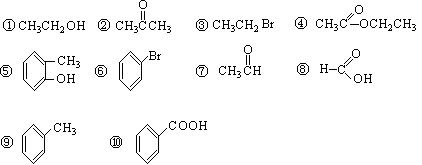
(1)芳香烃:; (2)卤代烃:;
(3)醇:;(4)醛:;
(5)羧酸:;(6)酯:。
Ⅰ.化合物甲、乙、丙有如下转化关系:
甲(C4H10O) 乙(C4H8)
乙(C4H8) 丙(C4H8Br2)
丙(C4H8Br2)
回答:
(1)甲中官能团的名称是________,甲可能结构有________种,其中可催化氧化为醛的有________种;使酸性KMnO4溶液褪色的有________种。
(2)甲→乙的反应类型为________,乙→丙的反应类型为________
Ⅱ.(1)乙醇、乙二醇、丙三醇中分别加入足量金属钠,产生等体积的氢气(相同条件下),则上述三种醇的物质的量之比是________。
(2)等质量的①甲醇 ②乙醇③乙二醇④丙三醇,分别和足量的金属钠作用,放出氢气的量由少到多的顺序是__________。(填序号)
含苯酚的工业废水的处理流程如图所示。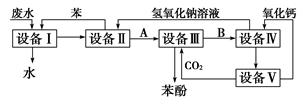
(1)①流程图设备Ⅰ中进行的是______操作(填写操作名称)。
②图中,能循环使用的物质是:C6H6、CO2______、______。
(2)为了防止水源污染,用简单而又现象明显的方法检验某工厂排放的污水中有无苯酚,此方法是_______________________________________________________。
(3)从废水中回收苯酚的方法是:①用有机溶剂萃取废液中的苯酚;②加入某种药品的水溶液使苯酚与有机溶剂脱离;③通入某物质又析出苯酚。试写出②、③两步的反应方程式:
_________________________________________________________________________________________。
Ⅰ.有机物A可视为是烃B分子中的所有氢原子被烃C分子中最简单的烃基取代而得到的。且已知:①A遇Br2的CCl4溶液不褪色,其一氯代物只有一种。②一定量的B完全燃烧,产物中n(CO2):n(H2O)=2:1,且26<M(B)<78。③烃C为饱和链烃,通常情况呈气态,其同分异构体不超过2种,其二溴代物有3种。试回答下列问题:
(1)烃B的最简式为______,分子式为______。
(2)烃C的名称为。
(3)A的分子式为________。
Ⅱ.1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度是2.18克/厘米3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验中可以用下图所示装置制备1,2-二溴乙烷。其中分液漏斗和烧瓶a中分别装有浓硫酸和乙醇溶液,试管d中装有浓溴(表面覆盖少量水)。请填写下列空白: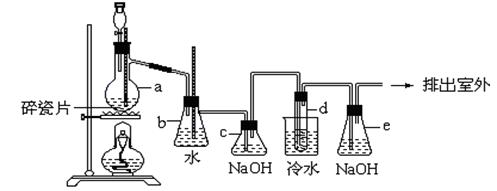
(1)请写出烧瓶a中发生的化学反应方程式:。
(2)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象:。
(3)c装置内NaOH溶液的作用是;e装置内NaOH溶液的作用是。