一化学兴趣小组在家中进行化学实验,按照左图连接好线路发现灯泡不亮,按照右图连接好线路发现灯泡亮,由此得出的结论正确的是( )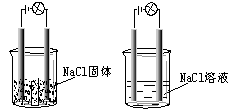
| A.NaCl固体中没有离子 |
| B.NaCl溶液是电解质 |
| C.NaCl溶液在电流作用下电离出大量的离子 |
| D.NaCl在水溶液中电离出了可以自由移动的离子 |
某溶液中含有SO32-、SiO32-、Br-、CO32-、Na+,向该溶液中通入过量的Cl2,下列判断正确的是( )
①反应前后,溶液中离子浓度基本保持不变的只有Na+
②有胶状物质生成
③有气体产生
④溶液颜色发生变化
⑤共发生了2个氧化还原反应
| A.①②③④⑤ | B.①②③④ | C.①③⑤ | D.②④⑤ |
高铁酸钾( K2FeO4)是一种新型的自来水处理剂,它的性质和作用是
| A.有强氧化性,可消毒杀菌,还原产物水解后能吸附水中杂质 |
| B.有强还原性,可消毒杀菌,氧化产物水解后能吸附水中杂质 |
| C.有强氧化性,能吸附水中杂质,还原产物能消毒杀菌 |
| D.有强还原性,能吸附水中杂质,氧化产物能消毒杀菌 |
下列叙述正确的是( )
| A.氯化铝溶液中加入过量氨水的反应实质是:Al3+ + 3NH3·H2O ===Al (OH)3↓ + 3NH4+ |
| B.Al(OH)3是两性氢氧化物,所以它能溶解于盐酸或氨水中 |
| C.加入KSCN溶液显红色的溶液中,Na+、Ca2+、HCO3-、I- 可以大量共存 |
| D.标准状况下,2.24 L NH3溶于1L水中制得氨水,则所得氨水的物质的量的浓度为0.1mol·L-1 |
下列涉及离子方程式书写的评价合理的是()
已知电离平衡常数:H2CO3>HClO>HCO3-,氧化性:HClO>Cl2>Br2>Fe3+>I2。下列有关离子反应或离子方程式的叙述中,正确的是()
| A.能使PH试纸显深红色的溶液中,Fe3+、Cl-、Ba2+、Br-能大量共存 |
| B.向溴水中加入足量氯化亚铁溶液能使溴水变成无色 |
| C.向NaClO溶液中通入少量二氧化碳的离子方程式: 2ClO-+CO2+H2O=2HClO+CO32- |
| D.向FeI2溶液中滴加少量氯水,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl- |