(1)某化学课外小组用海带为原料制取少量碘水,现在用四氯化碳在碘水中萃取碘单质,并用分液漏斗分离两种溶液。其实验操作可分解为如下几步:
| A.把盛有溶液的分液漏斗敖在铁架台的铁圈中: |
| B.把50mL碘水和15mL四氯化碳加入分液漏斗中,并盖好玻璃塞: |
| C.检验分液漏斗活塞和上口玻璃塞是否漏液; |
| D.倒转漏斗,用力振荡,并不时旋开活塞放气,最后关闭活塞: |
E.放开活塞,用烧杯接收溶液;
F.从分液漏斗上口倒出上层水溶液;
G.将漏斗上口的玻璃塞打开或使塞上的凹槽(或小孔)对准漏斗口上的小孔:
H.静置、分层。就此实验,完成下列填空:
正确操作步骤的顺序是: 。
(2)向MnSO4和硫酸的混合溶液里加入K2S2O8(过二硫酸钾),溶液会发如下反应:Mn2++S2O82‾+H2O—MnO4‾+SO42‾+H+
该反应常用于检验Mn2+的存在。其特征现象是 。
若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有 。
(3)将NaBiO3固体(黄色微溶)加入到MnSO4和H2SO4的混合溶液里加热,固体溶解变为澄清溶液,发生如下反应: NaBiO3+ MnSO4+ H2SO4— Na2SO4+ Bi2(SO4)3+ NaMnO4+ H2O
①配平上述反应的化学方程式,并标出电子转移的方向和数目:
②上述反应中还原产物是
(4分)有以下几种物质①NaCl(l) ②HCl(l) ③水银 ④蔗糖 ⑤液态醋酸⑥KNO3溶液 ⑦氯 气⑧液态SO3⑨纯水⑩熔融KOH,填空回答(填序号):以上物质中能导电的是;属于电解质的是;属于非电解质的是;属于弱电解质的是;
气⑧液态SO3⑨纯水⑩熔融KOH,填空回答(填序号):以上物质中能导电的是;属于电解质的是;属于非电解质的是;属于弱电解质的是;
同温同压下,相同体积的SO2和H2S气体的分子数之比是,质量之比是,密度之比是。两种气体等体积混合后的平均摩尔质量是,该混合气体对氢气的相对密度是。同温同压下,相同质量的SO2和H2S气体的分子数之比是,体积之比是,所含原子数之比。
有四种元素A、B、C、D,其中B2-离子与C+离子核外都有二个电子层,B原子的质子数与C原子的质子数之和等于D原子的质子数,A原子失去一个电子后变成一个质子,试回答:
(1)A、B、C、D的元素符号分别为、、、。
(2)B2-的电子式为,D原子的原子结构示意图为,
C+离子的结构示意图为。
(3)写出与C+具有相同电子数的五种分子(化学式):、、、
、。
(1)将下列科学家与他们的原子结构模型用线连接起来: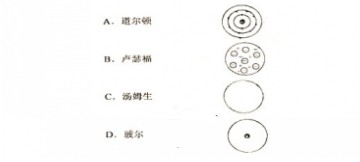
原子结构发展阶段的历史顺序是(用序号A、B、C、D填写)
(2)原子结构的演变过程表明(多项选择,选填序号)
A.人类对某一事物的认识是无止境的,是发展变化的。
B.现代原子结构已经完美无缺,不会再发展。
C.科学技术的进步,推动了原子学说的发展。
D.科学理论的发展过程中的不完善现象在许多科 学领域都存在,随着科学的不
学领域都存在,随着科学的不 断发
断发 展将会得到补充和完善。
展将会得到补充和完善。
(3)在打开原子结构大门的过程中,科学家运用了许多科学方法,除模型方法外,请从下列方法中选择出人们在认识原子结构过程中所运用的科学方法(多项选择,填写序号)
① 实验方法②假说方法③ 类比方法④推理方法
A、B、C、D四种可溶性盐,其阳离子分别是Na+、Ba2+、Cu2+、Ag+ 中的某一种,阴离子分别是Cl-、SO42-、CO32-、NO3- 中的某一种。现做以下实验:
① 将四种盐各取少量,分别溶于盛有5 mL蒸馏水的四支试管中,只有B盐溶液呈蓝色。
② 分别向4支试管中加入2 mL稀盐酸,发现A盐溶液中产生白色沉淀,C盐溶液中有较多气泡产生,而D盐溶液无明显现象。
(1)根据上述事实,推断这四种盐的化学式分别为:
A  B
B  C
C  D
D
(2)写出实验步骤②中涉及到的所有反应的离子方程式:
