实验室用浓硫酸和乙醇制取乙烯时,常会看到烧瓶中液体变黑,并在制得的乙烯中混
有CO2、SO2等杂质。某课外小组设计了如图所示装置,证明乙烯中混有CO2、SO2并验
证乙烯的性质。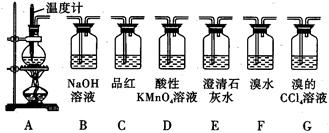
回答下列问题:
(1)烧瓶中素烧瓷片的作用是 。
(2)若要检验A中所得气体含有SO2,可将混合气体直接通入 (填图中代号,下同)装置;若要检验A中所得气体含有CH2=CH2,可将混合气体先通过B装置再通入 装置,也可将混合气体干燥后直接通入 装置。
(3)小明将从A出来的混合气体依次通过B、E、D、E,发现D前面的石灰水中无明显变化、D后面的石灰水变浑浊。请对出现该现象的原因进行合理猜想 。
(4)若要一次性将三种气体全部检验出来:
①检验的顺序是(填气体名称) ;
②上述装置组装的顺序中最简便的是:A→ ,证明C02存在的现象是 。
甲、乙同学在学完酸的化学性质后,做了如下实验:
实验结束,甲、乙同学依次将废液缓慢倒入同一洁净的废液缸中,然后进行了讨论。
【观察与讨论1】甲同学在做实验时没有观察到明显现象,于是对氢氧化钙溶液和稀盐酸能发生反应表示怀疑。但乙同学认为,甲同学实验时向氢氧化钙溶液中应先滴几滴酚酞试液,再滴加适量的稀盐酸,当观察到(1)时,就可以说明两种物质能发生反应。
【观察与讨论2】当乙同学沿废液缸内壁缓慢倾倒液体时,观察到废液缸中先有气泡产生,然后又出现了白色沉淀。经过讨论确定,甲、乙同学试管中废液含有的溶质分别是(2)(3)(均写化学式),才会出现上述现象。
为了科学处理试验后的废液,甲、乙同学决定对废液缸中最终废液溶质的成分进行探究。
【提出问题】最终废液中含有什么溶质?
【猜想与假设】甲同学猜想:废液中含有NaCl、CaCl2两种物质
乙同学猜想:废液中含有NaCl、Na2CO3两种物质
【活动与探究】甲、乙同学为了验证自己的猜想分别同时进行了如下实验:
甲同学实验:取少量废液于试管中,向其中滴加碳酸钠溶液,无明显现象。
得出结论:甲猜想不成立,则 乙猜想成立。
乙同学实验:取少量废液于试管中,向其中滴加氯化钙溶液,出现白色沉淀。
得出结论:乙猜想成立,则甲猜想不成立。
【反思与评价】(4)请对甲同学由实验现象得出的结论给予评价。
【表达与交流】(5)甲、乙同学确认了最终废液中溶质的成分。你认为处理该废液的方法是。
某化学兴趣小组在甲、乙两个充满氧气的密闭容器中各加入一定量的碳粉,在高温条件下使其充分反应,待反应结束后,两个容器中的碳粉都已完全消失。该小组成员对反应后两容器内气体进行如下探究:
⑴小红同学对甲容器中气体的组成提出如下四种猜想:
①只有CO②只有CO2③只有O2④CO和O2的混合气体
你认为上述猜想中明显不合理的是(填序号)
⑵小明同学认为甲容器中的气体还可能是CO和CO2的混合气体,为了验证自己的猜想,他准备按下图所示装置进行探究。
请你回答下列问题:
若小明的猜想成立,则装置A中反应的化学方程式是;装置C玻璃管中的实验现象是,反应的化学方程式是。
⑶小芳同学对乙容器中气体的组成提出了除上述猜想外的另一种合理猜想,她的猜想是,于是她设计了下列实验方案验证其猜想:
【步骤1】先加热装有铜丝网的玻璃管一段时间后,再通入乙中的气体,观察现象;
【步骤2】将乙中的气体通入澄清石灰水,观察现象。
指导老师在分析其实验方案后,指出了其中存在的错误或不足。
①步骤1应先通入乙中气体一段时间后方可加热。你认为这样修改的原因是。
②没有必要进行步骤2的实验,其理由是。
⑷若反应前甲、乙两容器中碳粉与氧气的质量比分别表示为 (mC/mO2)甲
和(mC/mO2)乙,当小明和小芳的猜想均成立时,则(mC/mO2)甲__________
(mC/mO2)乙(填“﹥”、“﹤”或“=”)。
(10分)如图所示,在实验室里,通常利用浓硫酸与乙醇混合加热制乙烯,加热一段时间后观察到烧瓶中溶液变黑,装置(Ⅱ)中经硫酸酸化的高锰酸钾溶液褪色。
⑴甲同学认为酸性高锰酸钾溶液褪色,能证明乙烯被酸性高锰酸钾溶液氧化了,你认为甲同学的观点是否正确?____________(填“是”或“否”),理由是___________(填字母)。
| A.(Ⅱ)瓶中酸性高锰酸钾溶液褪色,能证明乙烯发生了氧化反应 |
| B.(Ⅱ)瓶中酸性高锰酸钾溶液褪色,能证明乙烯发生了加成反应 |
| C.(Ⅱ)瓶中酸性高锰酸钾溶液褪色,不能证明通入的气体是纯净物 |
| D.(Ⅱ)瓶中酸性高锰酸钾溶液褪色,只能证明通入的气体一定具有还原性 |
⑵乙同学取(Ⅱ)瓶中少量溶液于试管里,加入盐酸和氯化钡溶液,产生白色沉淀。据此他认为乙烯中一定混有SO2,你认为他的结论是否可靠?_______________(填“是”或“否”),理由是__________________________________________________________。若你认为不可靠,请改进上述实验方案,证明乙烯中是否含有SO2:_______________________________。
⑶丙同学在装置(Ⅰ)和(Ⅱ)之间增加了一个装有足量_____________溶液的洗气瓶,即可证明乙烯能被酸性高锰酸钾溶液氧化。
食醋分为酿造醋和配制醋两种。国家标准规定酿造食醋总酸含量不得低于3.5g/100mL。
(1)某研究小组利用滴定分析法测定某品牌食醋中醋酸的含量,下列说法正确的是______
a.用NaOH溶液滴定时反应的离子方程式为:H++OH-=H2O
b.食醋试样需稀释一定倍数后再进行滴定
c.用NaOH溶液滴定食醋,可使用酚酞或甲基橙作指示剂
d.若测得该品牌食醋的物质的量浓度为0.75mol·L-1,则该食醋的总酸量为4.5g/100mL。
(2)研究小组的同学仔细观察了该品牌食醋的标签,发现其中还含有苯甲酸钠作为食品添加剂,他想用资料法验证醋酸与食品添加剂(苯甲酸钠C6H5COONa)不会发生离子互换反应,需查找在一定温度下的醋酸与苯甲酸的________(填写序号)。
a.pH b.电离度 c.电离常数 d.溶解度
(3)常温下,用0.1000 mol·L-1NaOH溶液分别滴定20.00mL 0.1000 mol·L-1HCl溶液和20.00mL 0.1000 mol·L-1CH3COOH溶液,得到2条滴定曲线,如下图所示。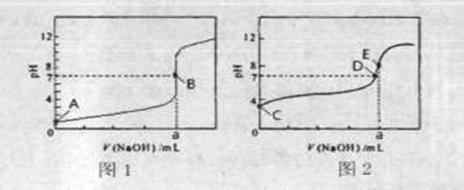
①滴定醋酸溶液的曲线是_______ (填“图l”或“图2”);滴定曲线中a=_____ mL;
②E点pH>8的原因用离子方程式表示________。
(4)现欲粗略测定一未知浓度的CH3COOH溶液的电离度,应做的实验和所需的试剂(试纸)是________(填写序号)
a.电解,NaOH溶液 b.蒸馏,Na2CO3溶液
c.酯化反应,石蕊试液 d.中和滴定,pH试纸
(5)为标定某醋酸溶液的准确浓度,用0.2000 mol?L-1的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
| 实验序号 |
1 |
2 |
3 |
4 |
| 消耗NaOH溶液的体积(mL) |
20.05 |
20.00 |
18.80 |
19.95 |
则该醋酸溶液的准确浓度为________。
下图是实验室制取Cl2并以Cl2为原料进行特定反应的实验:
(1)A为氯气发生装置,写出反应的化学方程式________________________。
(2)实验开始先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处的酒精灯。
Cl2通过C瓶后进入D,D装置内盛有碳粉,发生氧化还原反应,生成CO2和HCl,写出D装置中反应的化学方程式_____;装置C的作用是。
(3)E处石蕊试液的现象是_______________;其原因是__________________。
(4)若将E处溶液改为石灰水,反应过程的现象是_____________________________。
A.有白色沉淀生成 B.无白色沉淀生成 C.先生成白色沉淀,然后沉淀消失
(5)D处反应完毕后,关闭旋塞K,移去酒精灯,由于余热的作用,A处仍有少量Cl2产生,此时B中的现象是________________,B的作用是________________。