可逆反应2NO2 2NO+O2在体积固定的密闭容器中,达到平衡状态的标志是
2NO+O2在体积固定的密闭容器中,达到平衡状态的标志是
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2,NO,O2表示的反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
| A.①④⑥⑦ | B.②③⑤⑦ | C.①③④⑤ | D.全部 |
实验室制取氧气的反应为2KClO3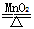 2KCl+3O2↑,反应后从剩余物中回收纯净的二氧化锰的操作顺序正确的是(已知MnO2为黑色难溶于水的固体)
2KCl+3O2↑,反应后从剩余物中回收纯净的二氧化锰的操作顺序正确的是(已知MnO2为黑色难溶于水的固体)
| A.溶解、过滤、蒸发、洗涤 | B.溶解、过滤、洗涤、干燥 |
| C.溶解、蒸发、洗涤、过滤 | D.溶解、洗涤、过滤、加热 |
完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是
| A.用CCl4提取溴水中的Br2 |
B.从KI和I2的固体混合物中回收I2 |
C.稀释浓硫酸 |
D.工业酒精制备无水酒精 |
 |
 |
 |
 |
离子方程式H++OH-===H2O所表示的反应是
| A.所有酸和碱之间的中和反应 |
| B.所有强酸和强碱之间的中和反应 |
| C.所有可溶性酸和可溶性碱的反应 |
| D.强酸与强碱生成可溶性盐和水的反应 |
下列有关实验操作正确的是
| A.蒸馏实验中温度计的水银球应插入液态混合物中 |
| B.用酒精萃取碘水中的碘 |
| C.分液时,打开旋塞,使下层液体从下口流出,上层液体从上口倒出 |
| D.开始蒸馏时,应该先加热,再开冷凝水;蒸馏完毕,应先关冷凝水再撤酒精灯 |
在下列溶液中Cl- 的物质的量浓度最大的是
| A.0.5L 0.1mol/L的NaCl溶液 | B.100mL 0.2mol/L的MgCl2溶液 |
| C.1L 0.2mol/L的AlCl3溶液 | D.1L 0.3mol/L盐酸溶液 |