根据铜锌原电池示意图,回答下列问题:
(1)锌为 极,电极反应式为 ;铜为 极,电极反应 为 ,原电池总离子反应式是 。
(2)若以该电池作为电源,以石墨碳棒为电极电解CuCl2溶液,在电池的工作过程中,Zn极质量变化了3.25g,则Cu极质量 (填“增加”、“不变”或“减少”);电子从电池的锌极沿导线流向电解池的 (填“阴极”或“阳极”,下同);在电解池中Cu2+向 移动,在该电极上析出铜的质量为 g。
已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B和C属同一主族,D和E属同一周期,又知E是周期表中1~18列中的第7列元素。,D跟B可形成离子化合物其晶胞结构如图。
请回答:
(1)A元素的名称是________;
(2)B的元素符号是________,C的元素符号是________,B与A形成的化合物比C与A形成的化合物沸点高,其原因是________________;
(3)E属元素周期表中第________周期,第________族的元素,其元素名称是________,它的+2价离子的电子排布式为________________;
(4)从图中可以看出,D跟B形成的离子化合物的化学式为________;该离子化合物晶体的密度为a g·cm-3,则晶胞的体积是________(只要求列出算式)。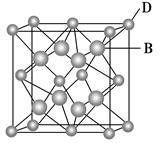
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力。
(1)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,写出基态镍原子的核外电子排布式的简化形式。
(2)富勒烯衍生物由于具有良好的光电性能,在太阳能电池的应用上具有非常光明的前途。富勒烯(C60)的结构如右图,分子中碳原子轨道的杂化类型为;1 mol C60分子中σ键的数目为。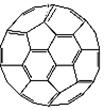
(3)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓、硫化镉、硫化锌及铜锢硒薄膜电池等。
①第一电离能:AsSe(填“>”、“<”或“=”)。
②二氧化硒分子的空间构型为。
由短周期元素组成的A、B、C、D、E、F六种微粒,其中只有C、D是分子,其余四种是离子,且每个微粒中都含有10个电子。已知A、E是由非金属元素组成的阳离子,六种微粒间有下列关系:
①A、B两种离子在加热条件下可生成C、D两种分子;
②通常状况下C的聚集状态为气态,且可使湿润的红色石蕊试纸变蓝;
③1 mol B离子与1 mol E离子作用可生成2 mol D分子;
④向含F离子的溶液中加入C的溶液,可生成白色沉淀W,C溶液过量沉淀也不消失,但再加入含大量B离子或大量E离子的溶液,沉淀W都会溶解。
(1) 微粒A的化学式是_____________;微粒E的名称是___________________。构成微粒F的元素在元素周期表中的位置是____________________________。
(2) 写出F与过量C溶液反应的离子方程式:_________________________
(3) 写出由C的水溶液制[Cu(NH3)4]SO4·H2O晶体的两个主要离子反应方程式:
(8分)有下列九种晶体,完成下列各小题。
①金刚石 ②C60 ③锌④晶体氖 ⑤氯化铵 ⑥金刚砂 ⑦冰醋酸 ⑧干冰 ⑨氧化钠
(1)属于分子晶体的是________,属于原子晶体的是________,属于离子晶体的是________。
(2)属于电解质的是________。
(3)直接由原子构成的晶体是________。
(4)含有极性共价键的晶体是________。
(5)晶体中有氢键的是________________,受热熔化需克服共价键的是________。
某些化学键的键能如下表所示(kJ·mol-1):
| 键 |
H-H |
Br-Br |
I-I |
Cl-Cl |
H-Cl |
H-I |
H-Br |
| 键能 |
436 |
193 |
151 |
247 |
431 |
299 |
356 |
(1)把1mol Cl2分解为气态原子时,需要_______(填“吸收”或“放出”) ________能量
(2)1mol H2在2mol Cl2中燃烧,放出的热量_______KJ。
(3)由表中所列化学键形成的单质分子中,最稳定的是________,最不稳定的是________,形成的化合物分子中,最稳定的是__________,最不稳定的是__________.
(4)在一定条件下,1mol H2与足量的Cl2、Br2、I2分别反应,放出热量由多到少的是____。
A.Cl2 > Br2 > I2 B.I2 > Br2 > Cl2
(5)预测1mol H2在足量F2中燃烧比在Cl2中放热。
(6)在液态HCl、HBr、HI中沸点最高的是。