下列说法中不正确的是
| A.在标准状况下22.4LH2中含有的氢分子的个数为NA |
| B.1L1mol/L的KClO3溶液中含有的Cl-个数为NA |
| C.凡是溶于水能导电的化合物就是电解质 |
| D.某溶液中滴加烧碱溶液,加热产生能使湿润的红色石蕊试纸变蓝的气体,则原溶液中一定存在NH4+ |
下列实验方案合理的是 ( )
| A.在镀件上电镀铜时,可用金属铜做阳极,用盐酸做电解质溶液 |
| B.往碘化银沉淀中滴加氯化钠溶液,使碘化银沉淀转化为氯化银 |
| C.制备FeCl3 溶液时,先将固体溶于较浓的盐酸,再加水稀释 |
| D.用湿润的PH试纸测量某酸溶液的PH,测出溶液的酸碱性 |
柠檬水中的c (OH-) =10-11 mol/L,则其PH是 ( )
| A. 11 | B. 7 | C. 5 | D. 3 |
现有碳酸钠、碳酸氢钠、氢氧化钠、氯化铁和苯酚五种物质的溶液,它们之间有如图所示转化关系,图中每条线两端的物质均可以发生反应,下列判断合理的是 
| A.X一定是碳酸氢钠溶液 |
| B.Y不可能为氯化铁溶液 |
| C.Z可能为氢氧化钠溶液 |
| D.M、N必定各为苯酚、氢氧化钠溶液中的某一种 |
控制适合的条件,将反应2 Fe 3++2I- 2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是
2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是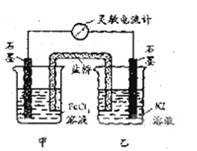

A.反应开始时,乙中石墨电极上发生氧化反应   |
B.电流计读数为零后,在甲中溶入FeCl2固体, 乙中石墨电极为负极 |
| C.反应开始时,甲中石墨电极上Fe3+被还原 | |
| D.电流计读数为零时,反应达到化学平衡状态 |
在固定容积的密闭容器中,放入a mol X,发生如下反应2X( ?) Y(g)+Z(s),
Y(g)+Z(s),
并达到平衡状态,此时升高温度,气体的密度增大。下列叙述正确的是
| A.压强的变化(可以通过改变容器的体积实现)对该平衡没有影响 |
| B.若正反应为放热反应,则X一定为气态 |
| C.若X为非气态,则正反应为放热反应 |
| D.若X为气态,再向容器中充入a mol X,达到新平衡后,与第一次平衡相比, |
X的体积分数增大