0.1mol·L-1Na2S溶液,下列关系正确的是
| A.c(Na+)=2c(S2-) |
| B.c(OH-)="c" (H+)+c (HS-)+2c (H2S) |
| C.c(Na+) >c(S2-) >c (HS-) >c (OH-) |
| D.c(Na+)+c (H+)="2c" (S2-)+c (HS-)+c (OH-) |
某酸的酸式盐NaHY的水溶液中,HY-的电离程度小于HY-的水解程度,有关叙述中正确的是()
A.H2Y在电离时为:H2Y+H2O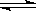 HY-+H3O+ HY-+H3O+ |
| B.在该盐的溶液中,离子浓度为:c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+) |
| C.在该盐的溶液中,离子浓度为:c(Na+)>c(HY-)>c(Y2-)>c(OH-)>c(H+) |
D.HY-的水解方程式为:HY-+H2O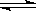 H3O++Y2- H3O++Y2- |
20℃时,两种一元弱酸的钠盐NaX和NaY,已知,往NaX溶液中通入CO2只能生成HX和NaHCO3;往NaY溶液中通入CO2能生成HY和Na2CO3,下列说法正确的是( )
| A.酸性HY>HX |
B.结合H+的能力Y->CO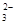 >X->HCO >X->HCO |
| C.溶液的碱性:NaX>Na2CO3>NaY>NaHCO3 |
| D.HX和HY酸性相同但比H2CO3弱 |
已知NaHSO4在水中的电离方程式为NaHSO4=Na++H++SO42-。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液pH为2。对于该溶液下列叙述不正确的是()
| A.该温度高于25℃ |
| B.水电离出来的c(H+)=1×10-10mol/L |
| C.c(H+)=c(OH-)+c(SO42-) |
| D.该温度下加入等体积pH为12的NaOH溶液可使反应后的溶液恰好呈中性 |
常温下,将甲酸和氢氧化钠溶液混合,所得溶液pH=7,则此溶液中()
| A.c(HCOO-)>c(Na+) | B.c(HCOO-)<c(Na+) |
| C.c(HCOO-)= c(Na+) | D.无法确定 c(HCOO-)与c(Na+)的关系 |
表示0.1mol/LNaHCO3溶液中有关微粒浓度大小的关系式,正确的是()
| A.(Na+)>c(HCO3-)>c(CO32-)>c(H+)>c(OH-) |
| B.(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-) |
| C.c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)>c(OH-) |
| D.c(H+)>c(H2CO3)>c(OH-)>c(HCO3-)>c(CO32-) |