氧化还原反应规律是化学学科的重要规律之一。按要求回答下列问题:
(1) 被称为万能还原剂的NaBH4溶于水并和水反应:NaBH4+2H2O=NaBO2+4H2↑,此反应中B元素的化合价没有发生变化,则NaBH4中H的化合价为___________,该反应氧化产物是______________,还原产物是______________。
(2) 有下列三个反应:
①Cl2+FeI2=FeCl2+I2 ;②2Fe2++Br2=2Fe3++2Br-;③Co2O3+6HCl=2CoCl2+Cl2↑+3H2O
①根据以上方程式可以得到Fe2+、Co2+、Br-、I-还原性由强的弱的顺序为_________;
②1molCo2O3能氧化HCl的物质的量_____________。
(3) 完成并配平下列化学反应方程式:
□KMnO4+□H2C2O4+□________ □CO2+□K2SO4+□MnSO4+□H2O
□CO2+□K2SO4+□MnSO4+□H2O
(4)一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”。如2H+ +Zn=Zn2++H2↑,可拆写为氧化反应式:Zn-2e-=Zn 2+,还原反应式:2H++ 2e-=H2↑。并由此实现了化学能与电能的相互转化。据此,回答下列问题:
①将2Fe3++Cu= 2Fe2+ +Cu2+拆写为两个“半反应式”:其中,氧化反应式为 。
②由①中的反应,可设计成如右图所示的原电池:
若电极a为Cu ,电解质溶液甲的化学式为 ;
电极b处的电极反应式为 。
纳米级四氧化三铁是应用最为广泛的软磁性材料之一,常用作记录材料,磁流体材料,催化剂,电子材料等。其在生物技术领域和医学领域也有很好的应用前景。共沉淀法是目前制备纳米四氧化三铁的重要方法,其流程如图示:
请回答下列问题:(1)实验室保存溶液A时,需加入。
(2)为了得到较纯的纳米Fe3O4,FeSO4·7H2 O 和 FeCl3·6H2O的物质的量之比最好应为,在此条件下,检验铁元素是否沉淀完全的实验操作是。
O 和 FeCl3·6H2O的物质的量之比最好应为,在此条件下,检验铁元素是否沉淀完全的实验操作是。
(3)写出制备纳米Fe3O4的离子反应方程式。
(4)共沉淀法的主要不足是:①得到的Fe3O4纳米粒子间存在团聚现象
②。
(5)磁流体是电子材料的新秀,它既具有固体的磁性,又具有液体的流动性,下列关于纳米Fe3O4磁硫体的说法中不正确的是:。
| A.纳米Fe3O4磁硫体分散系属于溶液。 |
B.纳米Fe3O4磁硫体可 以通过渗析法得到提纯。 以通过渗析法得到提纯。 |
| C.当一束可见光通过该磁硫体时会出现光亮的通路。 |
| D.纳米Fe3O4磁硫体比较稳定。 |
1 L某混合溶液,可能含有的离子如下表:
| 可能大量含有的阳离子 |
H+NH4+Al3+K+ |
| 可能大量含有的阴离子 |
Cl-Br-I‑ClO‑AlO2- |
(1)往该溶液中逐滴加入NaOH溶液并适当加热,产生沉淀和气体的物质的量(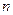 )与加入NaOH溶液的体积(
)与加入NaOH溶液的体积(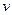 )的关系如右图所示。
)的关系如右图所示。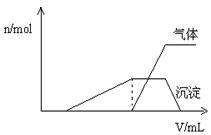
则该溶液中确定含有的离子有__ _____ __;
_____ __;
不能确定是否含有的阳离子有_______ ___,
要确定其存在可补充做的实验是______ _;
肯定不存在的阴离子有________ ___。
(2)经检测,该溶液中含有大量的 Cl- 、Br-、I-,若向1 L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积标准状况)的关系如下表所示,分析后回答下列问题:
Cl- 、Br-、I-,若向1 L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积标准状况)的关系如下表所示,分析后回答下列问题:
| Cl2的体积(标准状况) |
2.8L |
5.6 L |
11.2 L |
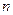 (Cl-) (Cl-) |
1.25mol |
1.5 mol |
2 mol |
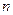 (Br-) (Br-) |
1.5 mol |
1.4 mol |
0.9 mol |
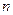 (I-) (I-) |
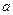 mol mol |
 0 0 |
0 |
①当通入Cl2的体积为2.8 L时,溶液中发生反应的离子方程式为___。
②原溶液中Cl-、Br-、I-的物质的量浓度之比为_____________。
下表为元素周期表的一部分,请用化学用语回答下列问题:
| 族 周期 |
IA |
0 |
||||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
② |
③ |
④ |
|||||
| 3 |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
(1)④、⑤、⑥的原子半径由大到小的顺序为_________________ ___(用元素符号表示)。
(2)请用化学方程式表示非金属性:②>⑦ _______ ____
(3)表中①、④两种元素的原子可按1:1组成一种具有二元弱酸性质的物质,请写出该物质
的电离方程式: 该弱酸性物质与⑤的最高价氧化物对应的水化物反应时可生成一种酸式盐,该酸式盐的电子式:
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生以 下反应:
下反应:
A.X溶液与Y溶液反应的离子方程式为______________ _______,
B.N→⑥的单质的化学方程式为________________。
C.常温下,为了使0.1 mol/L M 溶液中由M电离出的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至_____________ ____。
(5)由④、⑤、⑧三中元素形成的化合物溶液中,加入盐酸发生氧化还原反应的离子方程式是。
已知25℃时部分弱电解质的电离平衡常数数据如下表: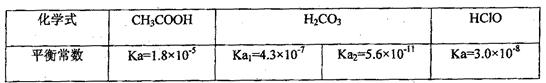
回答下列问题:
(1)物质的量浓度均为0.1mol·L-1的四种溶液:a.CH3COOH b.Na2CO3 c.NaClOd. NaHCO3;pH由小到大的排列顺序是(用字母表示)
NaHCO3;pH由小到大的排列顺序是(用字母表示)
(2)常温下,0.1mol·L-1的CH3COOH溶液加稀释过程中,下列表达式的数据变大的是
| A.c(H+) | B.c(H+)/c(CH3COOH) | C.c(H+)·c(OH-) | D.c(OH-)/c(H+) |
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数CH3COOH的电离平衡常数(填大于、小于或等于)
理由是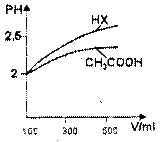
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中c(CH3COO-)—c(Na+)=mol·L-1(填精确值),c(CH3COO-)/c(CH3COOH)=
有两只密闭容器A和B。A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两个容器中分别充入等物质的量的体积比为2∶1的SO2和O2的混合气体,并使A和B容积相等(如下图所示)。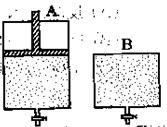
在保持400℃的条件下使之发生如下反应:2SO2+O2 2SO3。试填写下列空格:
2SO3。试填写下列空格:
(1)A容器达到平衡时所需的时间比B容器;(填“短”、“长”或“相等”)
平衡时A容器中SO2的转化率比B容器;(填“大”、“小”或“相等”)
(2)达到(1)所述平衡后,若向两容器中通入数量不多的等物质的量的氩气,A容器中化学
平衡移动,B容器中化学平衡;(填“逆向”、“正向”或“不移动”)
(3)达到(1)所述平衡后,若向两容器中通入等物质的量的原反应气体,达到平衡时,A容
器的混合气体中SO3的体积分数(填“增大”、“减小”或“不变”,下同);B容器的混合气体中SO3的体积分数。