金属在生产和生活中有广泛的应用.
(1)钢铁可以制成炒锅,主要利用了铁的延展性和 性.
(2)下列关于金属的说法正确的是 .
| A.常温下金属均为固态 |
| B.在铁制品表面刷漆防止铁锈蚀 |
| C.铜是目前世界年产量最高的金属 |
| D.金属与酸反应后溶液质量一定增加 |
E.铝表面易生成致密的氧化膜,因此铝有良好的抗腐蚀性
(3)某电镀厂为减少水污染及节约成本,从含有CuSO4、ZnSO4、FeSO4的废水中回收硫酸锌和有关金属,实验过程如下:
①步骤Ⅰ中加入过量M的目的是 ,写出该步骤中反应的化学方程式 .
②步骤Ⅲ的操作为 .
临汾不仅山清水秀、景色迷人,特色美食更是遍布各县,令各路“美食家”流连忘返。
(1)临汾“牛肉丸子面”风味独特,香辣扑鼻。从分子角度解释“香辣扑鼻”的原因是: ;
(2)北城水果批发市场“斋婆柚”汁多味美,齿颊生津。柚子皮还可以吸附室内异味,写出一种具有同样性质的化学物质的名称 ;
(3)我市部分县今年干旱,严重缺水,因地制宜利用水资源迫在眉睫。汾河为我们帮了大忙,可用 检验汾河水是硬水还是软水,日常生活中可以利用 的方法降低水的硬度;
(4)一场大火往往由一个小小的烟头引起,烟头在火灾发生中所引起的作用是 。干旱地区容易发生火灾。消防员利用高压水枪灭火的原理是 。
用相应的化学用语填空.
(1)保持水的化学性质的微粒 ;(2)铁原子 ;
(3)5个硫酸根离子 ;(4)标出“H2O2”中氧元素的化合价
(5)由“CO(NH2)2”尿素的化学式得到的信息:宏观①_________________________
微观②______________________(各写一条)
化学式为(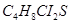 ),求:
),求:
(1)芥子气的相对分子质量______________。
(2)芥子气中碳、氯元素的质最比______________。(计算结果保留最简单整数比)
(3)芥子气中碳元素的质量分数______________。(计算结果保留小数点后一位数字)
配制50g质量分数为5%的氯化钠溶液,下图是某同学配制溶液的操作过程:
(1)写出标号①~④各仪器的名称:
①______________ ②______________ ③______________ ④______________
(2)B操作中应称氯化钠的质量是______________g,称量时若指针偏右,应进行的操作是____________________________。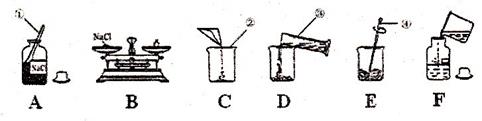
(3)D操作中仪器⑨的规格应为______________(填“10mL”、“50ml”或“100mL”)读数时应使视线与____________________________保持水平。
(4)E操作的作用是____________________________。
(5)下列错误操作可能导致溶质质量分数偏低的是______________。(填序号)
①B操作中砝码和氯化钠放错托盘 ②D操作中仰视凹液面的最低处读数
⑨D操作时有少量水溅出 ④F操作中溶液洒落
过滤操作中的要点常简记为“一贴二低三靠”,请你解释其具体含义:
①“一贴”:____________________________________________________________
②“二低”:________________________________________________________,
____________________________________________________________________;
③“三靠”:___________________________,_____________________________
_______________________________,_____________________________________。