铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原为Fe3+离子。制取铁酸钠的化学方程式如下:
(1)□Fe(NO3)3+□NaOH+□Cl2===□Na2FeO4+□NaNO3+□NaCl+□H2O
(2)在上述反应中 元素被氧化,当3molCl2参与反应时,转移电子的总数为 ;
(3)铁酸钠之所以能净水,除了能氧化杀菌外,另一个原因是 。
25℃时,向20.00 mL的NaOH溶液中逐滴加入某浓度的CH3COOH溶液。滴定过程中,溶液的pH与滴入CH3COOH溶液的体积关系如图所示,点②时NaOH溶液恰好被中和。则下列说法中,错误的是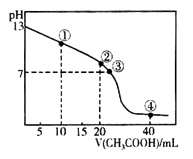
| A.CH3COOH溶液的浓度为0.1 mol·L-1 |
| B.图中点①到点③所示溶液中,水的电离程度先增大后减小 |
| C.点④所示溶液中存在:(CH3COOH)+c(H+)=c(CH3COO-)+c(OH-) |
| D.滴定过程中会存在:c(Na+)> c(CH3COO-)=c(OH-)> c(H+) |
向100mL0.1mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液中逐滴滴入0.1mol·L-1Ba(OH)2溶液。随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如下图所示。则下列说法中正确的是
| A.a点时溶液中所含主要溶质为(NH4)2SO4 |
| B.a→b段发生反应的离子方程式是: SO42-+Ba2+===BaSO4↓ |
| C.b点为最大沉淀量,对应的纵坐标值为0.02 |
| D.c点加入Ba(OH)2溶液的体积为200 mL |
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只能被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果错误的是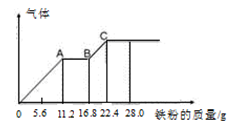
| A.混合酸液中NO3-的物质的量为0.4mol |
| B.OA段产生是NO,AB段反应为 2Fe3++Fe = 3Fe2+,BC段产生氢气 |
| C.溶液中最终溶质为FeSO4 |
| D.c(H2SO4)为5 mol·L-1 |
在1200℃时,天然气脱硫工艺中会发生下列反应:
H2S(g)+ O2(g)═SO2(g)+H2O(g) △H1
O2(g)═SO2(g)+H2O(g) △H1
2H2S(g)+SO2(g)═ S2(g)+2H2O(g) △H2
S2(g)+2H2O(g) △H2
H2S(g)+ O2(g)═S(g)+H2O(g) △H3
O2(g)═S(g)+H2O(g) △H3
2S(g)═S2(g)△H4 则△H4的正确表达式为
A.△H4=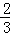 (△H1+△H2﹣3△H3) (△H1+△H2﹣3△H3) |
B.△H4=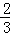 (3△H3﹣△H1﹣△H2) (3△H3﹣△H1﹣△H2) |
C.△H4= (△H1+△H2﹣3△H3) (△H1+△H2﹣3△H3) |
D.△H4= (△H1﹣△H2﹣3△H3) (△H1﹣△H2﹣3△H3) |
将一定质量的铁、氧化铁、氧化铜的混合物粉末放入100 mL 4.40 mol·L-1盐酸中,充分反应后产生896 mL H2(标准状况),残留固体1.28 g。过滤,滤液中无Cu2+。将滤液加水稀释到200 mL,测得其中c(H+)为0.400 mol·L-1。则原混合物中单质铁的质量是
| A.2.24 g | B.3.36 g | C.5.60 g | D.10.08 g |