300℃时,将2mol A和2mol B两种气体混合于2L密闭容器中,发生如下反应:3A(g)+B(g) 2C(g)+2D(g) △H,2min末达到平衡,生成0.8mol D。
2C(g)+2D(g) △H,2min末达到平衡,生成0.8mol D。
(1)在2min末时,A的平衡浓度为_____________,B的转化率___________,0-2min内D的平均反应速率为_____________。
(2)该反应的平衡常数表达式为:K=_____________。该温度下的化学平衡常数数值为 =____________。
=____________。
已知350℃时 =l,则△H________0(填“>”或“<”)。
=l,则△H________0(填“>”或“<”)。
(3)在300℃时,将该反应容器压缩体积为lL。则A的转化率___________(填“增大”、“减小”或“不变”),原因是__________________。该条件下的平衡常数为 。 则K3________
。 则K3________ ,(填“<”或“>”或“=”)。原因是_______________________。
,(填“<”或“>”或“=”)。原因是_______________________。
(4)能判断该反应是否达到化学平衡状态的依据是__________________(多选扣分)。
A.容器中压强不变 B.混合气体中c(A)不变
C. (A)=
(A)= (C) D.混合气体密度不变
(C) D.混合气体密度不变
CH4、H2、C都是优质的能源物质,它们燃烧的热化学方程式为:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1,
②2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1,
③C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1。
(1)在深海中存在一种甲烷细菌,它们依靠酶使甲烷与O2作用产生的能量存活,甲烷细菌使1 mol甲烷生成CO2气体与液态水,放出的能量________(填“>”“<”或“=”)890.3 kJ。
(2)甲烷与CO2可用于合成合成气(主要成分是一氧化碳和氢气):CH4+CO2=2CO+2H2,1 g CH4完全反应可释放15.46 kJ的热量,则:
①下图能表示该反应过程中能量变化的是________(填字母)。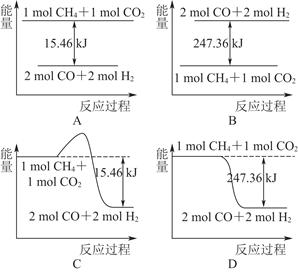
②若将物质的量均为1 mol的CH4与CO2充入某恒容密闭容器中,体系放出的热量随着时间的变化如图所示,则CH4的转化率为________。
(3)C(s)与H2(g)不反应,所以C(s)+2H2(g)=CH4(g)的反应热无法直接测量,但通过上述反应可求出,C(s)+2H2(g)=CH4(g)的反应热ΔH=________。
(4)目前对于上述三种物质的研究是燃料研究的重点,下列关于上述三种物质的研究方向中可行的是________(填字母)。
| A.寻找优质催化剂,使CO2与H2O反应生成CH4与O2,并放出热量 |
| B.寻找优质催化剂,在常温常压下使CO2分解生成碳与O2 |
| C.寻找优质催化剂,利用太阳能使大气中的CO2与海底开采的CH4合成合成气(CO、H2) |
| D.将固态碳合成为C60,以C60作为燃料 |
(1)在焙烧炉中发生反应:
①Fe2O3(s)+3C(s) 2Fe(s)+3CO(g) ΔH=-492.7 kJ·mol-1
2Fe(s)+3CO(g) ΔH=-492.7 kJ·mol-1
②3CO(g)+Fe2O3(s) 2Fe(s)+3CO2(g) ΔH=+25.2 kJ·mol-1
2Fe(s)+3CO2(g) ΔH=+25.2 kJ·mol-1
反应2Fe2O3(s)+3C(s) 4Fe(s)+3CO2(g) ΔH=________kJ·mol-1。
4Fe(s)+3CO2(g) ΔH=________kJ·mol-1。
(2)天然气(以甲烷计)在工业生产中用途广泛。甲烷蒸汽转化法制H2的主要转化反应如下:
CH4 (g)+H2O(g) CO(g)+3H2(g) ΔH=+206.2 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.2 kJ·mol-1
CH4(g)+2H2O(g) CO2(g)+4H2(g) ΔH=+165.0 kJ·mol-1
CO2(g)+4H2(g) ΔH=+165.0 kJ·mol-1
上述反应所得原料气中的CO能使氨合成催化剂中毒,必须除去。工业上常采用催化剂存在下CO与水蒸气反应生成易除去的CO2,同时又可制得等体积的氢气的方法。此反应称为一氧化碳变换反应,该反应的热化学方程式是_________________________________________。
化学反应可视为旧键断裂和新键形成的过程。现提供H2燃烧反应中有关物质的化学键键能: H—H键键能为Q1 kJ·mol-1、H—O键键能为Q3 kJ·mol-1、O2分子内氧原子间的键能为Q2 kJ·mol-1。
(1)请根据上述数据,在图中标注的数字处,填出能量变化的数值或根据箭头的指向填写能量变化是“放出”热量还是“吸收”热量。
(2)请写出1 molH2燃烧生成液态水的热化学反应方程式:____________________________。
有一种白色粉末,含有下列阴离子和阳离子中的几种。
阴离子:S2-、Cl-、NO3—、SO42—、CO32—、HCO3—、MnO4—。
阳离子:Na+、Mg2+、Al3+、Ba2+、Fe2+、Fe3+、Cu2+、NH4+。
将该白色粉末进行下列实验,观察到的现象如下:
| 实验操作 |
现象 |
| a.取少量粉末,加水、振荡 |
全部溶解、 |
| 溶液无色透明 |
|
| b.向所得溶液中慢慢滴入苛性钠溶液,并加热 |
无明显现象 |
| c.取少量粉末,加盐酸 |
无明显现象 |
| d.取少量粉末,加稀H2SO4和稀HNO3的混合液 |
有白色沉淀生成 |
根据实验推断:
(1)从a实验中,可推断粉末中不可能有______________(填离子符号,下同)。
(2)从b实验中,可推断粉末中不可能有_____________________________________。
(3)从c实验中,可推断粉末中不可能有________________________________。
(4)从d实验中,可推断粉末中不可能有________,一定含有________。
(5)以上各实验仍无法确定是否存在的离子是____________。
(1)某无色稀溶液X中,可能含有下表所列离子中的某几种。
| 阴离子 |
CO32—、SiO32—、AlO2—、Cl- |
| 阳离子 |
Al3+、Cu2+、Mg2+、NH4+、Na+ |
现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂Y的体积(V)的关系如图所示。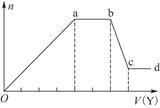
①若Y是盐酸,则溶液中含有的金属阳离子是_________________________________,
ab段发生反应的总离子方程式为___________________________________
表中Oa段与Y溶液反应的离子的物质的量之比为__________[要标明离子符号,如n(Na+)]。
②若Y是NaOH溶液,则bc段反应的离子方程式为______________________________
若不考虑离子的水解因素,忽略H+和OH-的影响,且溶液中只存在4种离子,则它们的离子个数比为___________________________________[按阳离子在前,阴离子在后,高价在前,低价在后的顺序排列]。
(2)锡为第ⅣA族元素,锡的单质和化合物与某些物质的化学性质上有许多相似之处。已知锡元素具有如下性质:
Sn4++Sn=2Sn2+;
2Sn2++O2+4H+=2Sn4++2H2O;
2H++SnO22— Sn(OH)2
Sn(OH)2 Sn2++2OH-。
Sn2++2OH-。
试回答:
①锡溶于盐酸,再向反应后的溶液中通入氯气,有关反应类似于铁的相应变化,试写出有关反应的离子方程式:______________________________________,
②将①中溶液蒸干后继续加热所得固体,变化过程类似于FeCl3溶液相应的变化,则最后得到的固体物质是(分子式)__________。
③若可用SnCl2溶液与过量的碱溶液反应的方法制Sn(OH)2, 该碱是__________。