合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料.从天然气获得合成气过程中可能发生的反应有:
①CH4(g)+H2O(g)⇌CO(g)+3H2(g)△H1=+206.1kJ/mol
②CH4(g)+CO2(g)⇌2CO(g)+2H2(g)△H2=+247.3kJ/mol
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H3
请回答下列问题:
(1)在一恒容密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图1所示.反应进行的前5min内, (H2)= ;10min时,改变的外界条件可能是 .
(H2)= ;10min时,改变的外界条件可能是 .
(2)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等.在相同温度下发生反应②,并维持反应过程中温度不变.已知甲容器中CH4的转化率随时间变化的图象如图3所示,请在图3中画出乙容器中CH4的转化率随时间变化的图象
(3)反应③中△H3= .800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
| CO |
H2O |
CO2 |
H2 |
| 0.5mol |
8.5mol |
2.0mol |
2.0mol |
此时反应③中正、逆反应速率的关系式是 (填代号).
a.v(正)>v(逆) b.v(正)<v(逆)
c.v(正)=v(逆) d.无法判断.
现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A、D同主族,C与E同主族,D、E、F同周期,A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C形成电子总数相等的分子,且A与C形成的化合物常温下为液态,A能分别与E、F形成电子总数相等的气体分子。
请回答下列问题:
(1)E、F气态氢化物的稳定性为____________ > ______________(用化学式表示)。
(2)E与F可形成E2F2的化合物,其电子式为___________,其晶体类型为__________。
(3)C、D形成的一种化合物能与D、E形成的化合物在溶液中发生氧化还原反应,其离子方程式为: ______________________________________。
(4)A、C、E三种元素形成的一种常见化合物H,其浓溶液在加热条件下可与a g铜反应,则被还原的H的物质的量为___________________。
(5)E的一种常见氧化物为大气污染物,实验室可用足量D的最高价氧化物的水化物来吸收,则吸收生成的盐溶液中离子浓度大小关系为: ___________________________。
(6)b g D单质在纯净的C单质中燃烧放出Q kJ热量,则相关的热化学方程式为: __________。
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
| 阳离子 |
Ag+ Na+ |
| 阴离子 |
NO3- SO42- Cl- |
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、B、c三种溶液,电极均为石墨电极
接通电源,经过一端时间后,测得乙中C电极质量增加了27克。常温下各烧杯中溶液的pH与电解时间t的关系图如上。据此回答下列问题:
(1)M为电源的:极(填写“正”或“负”),甲、乙电解质分别为、(填写化学式)。
(2)写出d电极上发生反应的电极反应式.
(3)若电解后甲溶液的体积为25L,且产生的气体全部逸出则该溶液常温时的pH为。
(4) 若丙装置产生的两种气体与氢氧化钠溶液、铂电极形成燃料电池,请写出正极的电极反应式:.
若丙装置产生的两种气体与氢氧化钠溶液、铂电极形成燃料电池,请写出正极的电极反应式:.
(5)要使电解后丙中溶液恢复到原来的状态,应加入物质。(填写化学式)
有机物A~F存在如 下转化关系,A的化合物的水溶液呈弱酸性,A、C分子中含C、H两元素的质量分数和均为85
下转化关系,A的化合物的水溶液呈弱酸性,A、C分子中含C、H两元素的质量分数和均为85 .19%,相对分子质量均为108。F含两个环且有一个对位甲基。
.19%,相对分子质量均为108。F含两个环且有一个对位甲基。
请回答下列问题:
(1)写出化合物A的分子式____________,B的结构简式________________。
(2)与C具有相同环的同分异构体共有_____________(含C)种,请写出其中两种不同类别有机物的结构简式(除C外)__________________、______________________。
(3)A中处于同一平面上的原子最多有__________个。
(4)写出F的结构简式____________________。
(5)写出反应④的化学方程式_________________________________
A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大。A原子核内无中子;A和E、D和F分别同主族,且B与D最外层电子数之比为2:3。试回答 下列问题:
下列问题:
(1)E元素在周期表中的位置是;
(2)已知101KPa时,A单质的燃烧热为285.8kJ/m01,请写出A单质完全燃烧生成液态水时的热化学方程式:;
(3)E单质在足量D单质中燃烧生成的化合物的电子式是;
(4)化合物X、Y均由A、D、E、F四种元素组成。
①X、Y均属于化合物(填“离子”或“共价”):
②X与Y的水溶液相混合发生反应的离子方程式为;
(5)化合物E2F的水溶液中滴入双氧水和稀硫酸,加热,有单质生成。其离子反应方程式为:。
(15分)高聚物E是常见的一次性塑料包装袋的主要成分,它的合成路线如下:
请回答下列问题:
(1)已知:烃A的蒸气对氢气的相对密度为39,则A的最简式为 ▲。
(2)由A生成B的反应类型是 ▲;写出由C生成D的方程式 ▲。
(3)已知化合物G(C8H6O4)是B的一种同分异构体与酸性高锰酸钾溶液反应后的产物,G的核磁共振氢谱有两组峰,且峰面积比为l:2,写出G的结构简式 ▲。
(4)在F的同分异构体中,含三个甲基的共有 ▲种。
(5)一次性塑料包装袋给我们生活带来便利的同时也带来了“白色污染”。最近我国科学院以麦芽为原料,研制出的一种新型高分子可降解塑料――聚丁内酯(其结构: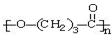 ),它可代替高聚物E,以减少“白色污染”。聚丁内酯可用环丁内酯开环聚合而成,其工业生产方法和降解原理如下:
),它可代替高聚物E,以减少“白色污染”。聚丁内酯可用环丁内酯开环聚合而成,其工业生产方法和降解原理如下:
①写出环丁内酯的结构简式: ▲;
②写出图中①的相应化学方程式▲。
③I在一定条件下可以合成一种重要化工原料J:

写出由I合成J的路线流程图(无机试剂任选)。
合成路线流程图书写示例如下: