已知:X、Y、Z、R四种短周期元素原子序数依次增大,X的气态氢化物水溶液呈碱性,Y原子的L层电子数是K层电子数的3倍,Z和R的单质在一定条件下与铜反应生成Cu2Z和CuR2,请根据要求填空。
(1)画出X的原子结构示意图 。R最高价氧化物对应水化物的化学式为 。
(2)Y、Z、R三种元素中原子半径最大的是 (用元素符号表示)。
(3)X气态氢化物与Z的最高价氧化物对应水化物反应生成的产物中所含化学键的类型为 ;检验该产物中阳离子的实验方法是 。
(4)R的单质通入到澄清石灰水中反应的离子方程式为 。
有可逆反应A+B 2C在不同温度下经过一定时间,混合物中C的百分含量与温度关系如下图所示,那么:
2C在不同温度下经过一定时间,混合物中C的百分含量与温度关系如下图所示,那么: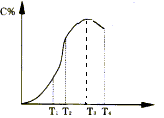 (1)反应在___________________温度下达到化学平衡;
(1)反应在___________________温度下达到化学平衡;
(2)此正反应为______________________热反应;
(3)由T1向T2变化时,V正____________V逆(填>、<、=);
(4)由T3向T4变化时,V正_____________V逆(填>、<、=).
下图甲池和乙池中的四个电极都是惰性材料,乙池溶液分层,下层为四氯化碳,上层溶液为盐溶液,呈中性,请根据图示回答下列问题: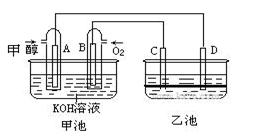
(1)通入甲醇的惰性电极的电极反应式为。若甲池可以充电,充电时A接电源的负极,此时B极发生的电极反应式为。
(2)在乙池反应过程中,可以观察到电极周围的溶液呈现棕褐色,反应完毕后,用玻璃棒搅拌溶液,则下层溶液呈现紫红色,上层接近无色, C极发生的电极反应式为。
某学生用0.1000 mol·L-1标准氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步: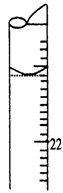
A.取20.00 mL待测盐酸溶液注入洁净的锥形瓶中,并加入2-3滴酚酞试液
B.用标准氢氧化钠溶液润洗滴定管2-3次
C.把盛有标准氢氧化钠溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D.取标准氢氧化钠溶液注入碱式滴定管至“0”刻度以上2-3mL处
E.调节液面至“0”或“0”刻度以下,记下读数,为3.10mL
|
F.把锥形瓶放在滴定管下面,用标准NaOH溶液滴定至终点并记下滴定管的读数。
回答下列问题:下面是常见的电化学装置图: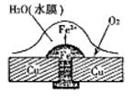
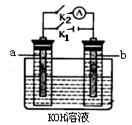
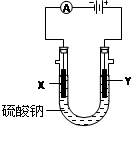
图1图2图3
请回答以下问题:(1)图1中铜板上铁铆钉处容易生锈,称为腐蚀,被腐蚀的金属是,原电池的总反应方程式是。 (2)图2中a、b是多孔石墨电极,断开K2,闭合K1一段时间,观察到两只玻璃管内都有气泡将电极包围,b极上的电极反应式为,OH-向(填a或b)极移动。然后断开K1,闭合K2,观察到电流计A的指针有偏转。b极上的电极反应式为,OH-向(填a或b)极移动。
(2)图2中a、b是多孔石墨电极,断开K2,闭合K1一段时间,观察到两只玻璃管内都有气泡将电极包围,b极上的电极反应式为,OH-向(填a或b)极移动。然后断开K1,闭合K2,观察到电流计A的指针有偏转。b极上的电极反应式为,OH-向(填a或b)极移动。
(3)图3中,X、Y都为石墨电极,在U型管两侧分别加入一滴紫色石蕊试液,则通电后X附近显______色,Y附近显_______色。
(16分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语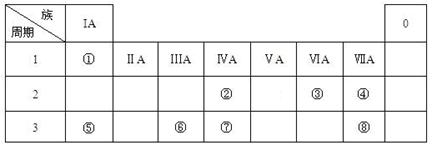
回答下列问题:
(1)④、⑤、⑥的原子半径由大到小的顺序为_______________________,②、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是______________________。
(2)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)_________________。
a.MnO2 b.FeCl 3 c.Na2SO3 d.KMnO4
若已知1 克该液态化合物分解成③的单质和一种常见液体时,可放出2.9kJ能量,写出该反应的热化学方程式:
(3)工业上常采用电解A和冰晶石(Na3AlF6)混合物的方法冶炼制备⑥的单质,请从A晶体的类型和微粒间的相互作用力角度解释加冰晶石(Na3AlF6)的原因。并写出电解时的电极反应式:。
(4)甲、乙、丙是上述部分元素组成的双原子分子或负二价双原子阴离子,且甲、乙、丙的电子总数相等。甲是一种极强的氧化性单质。丙与⑤的阳离子可形成一种淡黄色固体B,该固体跟水反应可得到③的单质。则B电子式,乙的结构式,甲的组成元素的原子结构示意图,能证明甲的组成元素非金属性很强的事实。(任举一例即可)