(16分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语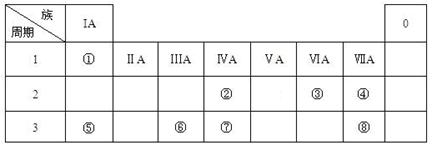
回答下列问题:
(1)④、⑤、⑥的原子半径由大到小的顺序为_______________________,②、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是______________________。
(2)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)_________________。
a.MnO2 b.FeCl 3 c.Na2SO3 d.KMnO4
若已知1 克该液态化合物分解成③的单质和一种常见液体时,可放出2.9kJ能量,写出该反应的热化学方程式:
(3)工业上常采用电解A和冰晶石(Na3AlF6)混合物的方法冶炼制备⑥的单质,请从A晶体的类型和微粒间的相互作用力角度解释加冰晶石(Na3AlF6)的原因 。 并写出电解时的电极反应式: 。
(4)甲、乙、丙是上述部分元素组成的双原子分子或负二价双原子阴离子,且甲、乙、丙的电子总数相等。甲是一种极强的氧化性单质。丙与⑤的阳离子可形成一种淡黄色固体B,该固体跟水反应可得到③的单质。则B电子式 ,乙的结构式 ,甲的组成元素的原子结构示意图 ,能证明甲的组成元素非金属性很强的事实 。(任举一例即可)
立方烷( )具有高度的对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点。下面是立方烷衍生物I的一种合成路线:
)具有高度的对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点。下面是立方烷衍生物I的一种合成路线: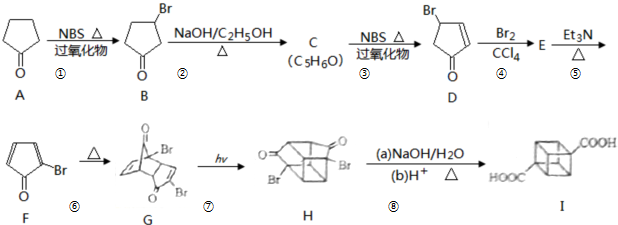
回答下列问题:
(1)C的结构简式为,E的结构简式为。
(2)③的反应类型为,⑤的反应类型为。
(3)化合物A可由环戊烷经三步反应合成:
反应1的试剂与条件为:反应2的化学方程式为:反应3可用的试剂为。
(4)在I的合成路线中,互为同分异构体的化合物是(填化合物代号)。
(5)I与碱石灰共热可转化为立方烷,立方烷的核磁共振氢谱中有个峰。
(6)立方烷经硝化可得到六硝基立方烷,其可能的结构有种。
A、B、C、D、E五种化合物,均含有前18号元素中某种常见元素,它们的转化关系如图所示,其中A为澄清溶液,C为难溶的白色固体,E则易溶于水,若取A溶液灼烧,焰色反应为浅紫色(透过蓝色钴玻璃)。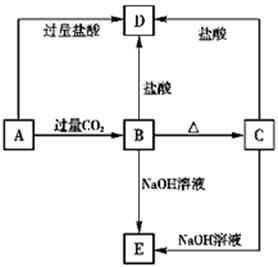
(1)写出化学式:A________,B________,C________,D________.
(2)写出下列反应的离子方程式:
B→D___________________,C→E_______________________
10 ℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
| 温度(℃) |
10 |
20 |
30 |
加热煮沸后冷却到50 ℃ |
| pH |
8.3 |
8.4 |
8.5 |
8.8 |
(1)甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为________________________________________________。
乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度________(填“大于”或“小于”)NaHCO3。
(2)丙同学认为甲、乙的判断都不充分。丙认为,只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则__________(填“甲”或“乙”)的判断正确。试剂X是________。
A.Ba(OH)2溶液 B.BaCl2溶液C.NaOH溶液D.澄清的石灰水
(3) 查阅资料,发现NaHCO3的分解温度为150 ℃,丙断言________(填“甲”或“乙”)的判断是错误的,理由是________________________________________。
25 ℃时几种难溶电解质的溶解度如表所示:
| 难溶电解质 |
Mg(OH)2 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
| 溶解度/g |
9×10-4 |
1.7×10-6 |
1.5×10-4 |
3.0×10-9 |
| 沉淀完全时的pH |
11.1 |
6.7 |
9.6 |
3.7 |
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些离子。例如:
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可。
请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe2+、Fe3+都被转化为__________(填化学式)而除去。
(2)①中加入的试剂应该选择__________。
(3)②中除去Fe3+所发生的离子方程式为________________________________。
(4)下列与方案③相关的叙述中,正确的是________(填字母)。
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在
某小组同学设想用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾。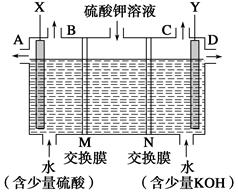
(1)X极与电源的________(填“正”或“负”)极相连,氢气从________(填“A”、“B”、“C”或“D”)口导出。
(2)离子交换膜只允许一类离子通过,则M为________(填“阴离子”或“阳离子”,下同)。
(3)若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池(石墨为电极),则电池负极的反应式为____________________________________________________。
(4)若在标准状况下制得11.2 L氢气,则生成硫酸的质量是____,转移的电子数为______。