某学生用0.1000 mol·L-1标准氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
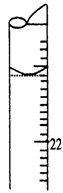
A.取20.00 mL待测盐酸溶液注入洁净的锥形瓶中,并加入2-3滴酚酞试液
B.用标准氢氧化钠溶液润洗滴定管2-3次
C.把盛有标准氢氧化钠溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D.取标准氢氧化钠溶液注入碱式滴定管至“0”刻度以上2-3mL处
E.调节液面至“0”或“0”刻度以下,记下读数,为3.10mL
|
F.把锥形瓶放在滴定管下面,用标准NaOH溶液滴定至终点并记下滴定管的读数。
回答下列问题:1mol某烃A和1 mol苯完全燃烧,烃A比苯多消耗1mol O2,若A分子结构中无支链或侧链,则:(1)若A为环状化合物,它能与等物质的量的Br2发生加成反应,则A的结构简式为;
(2)若A为链状烯烃,1mol A最多可和2mol Br2发生加成反应且A与等物质的量的Br2加成后的可能产物只有2种,则A的结构简式为。
有机物的结构可用“键线式”简化表示。CH3—CH=CH-CH3可简写为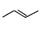 。
。
有机物X的键线式为:
(1)有机物Y是X的同分异构体,且属于芳香烃,写出Y的结构简式。
(2)Y与乙烯在一定条件下发生等物质的量聚合反应,写出其反应的化学方程式:
(3)X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有种。
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物。完成下列各题:
(1)正四面体烷的分子式为,其二氯取代产物有种
(2)关于乙烯基乙炔分子的说法错误的是:
a.能使酸性KMnO4溶液褪色
b.1摩尔乙烯基乙炔能与3摩尔Br2发生加成反应
c.乙烯基乙炔分子内含有两种官能团
d.等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量不相同
(3)写出与苯互为同系物且一氯代物只有两种的物质的结构简式(举两例):
、。
某甲烷和氢气的混合气体共a L,完全燃烧需要的氧气的体积也为a L,则原混合气体中,甲烷和氢气的体积比为______________。
甲烷在氯气中燃烧,可看到集气瓶内壁有黑色固体颗粒生成,瓶口产生大量白雾,根据以上现象分析,上述反应的化学反应方程式为_______________________________。