运用化学反应原理研究氮、硫等单质及其化合物的反应有重要意义
(1)硫酸生产过程中2SO2(g)+O2(g) 2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如图
2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如图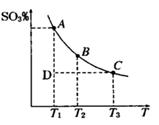 所示,根据图回答下列问题:
所示,根据图回答下列问题:
①2SO2(g)+O2(g) 2SO3(g)的△H__________0(填“>”或“<”)。
2SO3(g)的△H__________0(填“>”或“<”)。
②一定条件下,将SO2与O2以体积比2:1置于一体积不变的密闭容器中发生以上反应,能说明该反应已达到平衡的是 。
a.体系的密度不发生变化
b.SO2与SO3的体积比保持不变
c.体系中硫元素的质量百分含量不再变化
d.单位时间内转移4 mol 电子,同时消耗2 mol SO3
e.容器内的气体分子总数不再变化
(2)一定的条件下,合成氨反应为:N2(g)+3H2(g) 2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。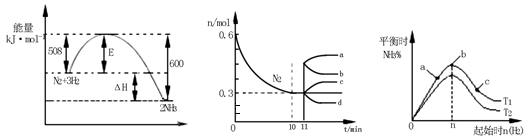
图1 图2 图3
①该反应的平衡常数表达式为 ,升高温度,平衡常数 (填“增大”或“减小”或“不变”)。
②由图2信息,计算0~10min内该反应的平均速率v(H2)= ,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为 。
③图3 a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是 点,温度T1 T2(填“>”或“=”或“<”)
(3)若将等物质的量的SO2与NH3溶于水充分反应,所得溶液呈 性,所得溶液中c(H+)- c(OH-)= (已知:H2SO3:Ka1=1.7×10-2,Ka2=6.0×10-8,NH3·H2O:Kb=1.8×10-5)
二氧化碳是一种宝贵的碳氧资源。以CO2和NH3为原料合成尿素是固定和利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应Ⅰ:2NH3(g)+CO2(g) NH2CO2NH4(s) △H1=-159.47kJ·mol-1
NH2CO2NH4(s) △H1=-159.47kJ·mol-1
反应Ⅱ:NH2CO2NH4(s) CO(NH2)2(s)+H2O(g) △H2=+72.49kJ·mol-1
CO(NH2)2(s)+H2O(g) △H2=+72.49kJ·mol-1
总反应Ⅲ:2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g) △H3=-86.98kJ·mol-1
CO(NH2)2(s)+H2O(g) △H3=-86.98kJ·mol-1
请回答下列问题:
(1)下列示意图中,能正确表示尿素合成过程中能量变化曲线是 。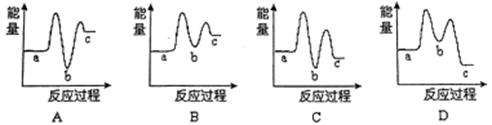
[a表示2NH3(g)+CO2(g),b表示H2NCOONH4(s),c表示CO(NH2)2(s)+H2O(g)]
反应Ⅲ在 (填“较高温度”或“较低温度”)下能自发进行。
(2)反应中影响CO2转化率的因素很多,下图甲为一定条件下,不同水碳比n(H2O)/n(CO2)和温度影响CO2转化率变化的趋势曲线。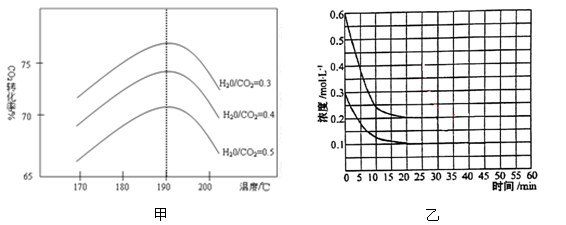
①其他条件相同时,为提高CO2的转化率,生产中可以采取的措施是 (填“提高”或“降低”)水碳比。
②当温度高于190℃后,CO2转化率出现如图甲所示的变化趋势,其原因是 。
(3)根据反应Ⅰ,在恒定温度下,将氨气和二氧化碳按2:1的物质的量之比充入体积为10L的密闭容器中(容器体积不变,固体体积忽略不计),经20min达到平衡,反应物浓度的变化曲线如图乙所示,若保持温度和体积不变,25min时再向容器中充入2mol氨气和1mol二氧化碳,在40min时重新达到平衡,请在图乙中画出25~45min内氨气的浓度变化曲线。
(4)尿素在土壤中会发生反应CO(NH2)2+2H2O (NH4)2CO3。
(NH4)2CO3。
①下列物质中与尿素有类似性质的是 。
| A.H2NCOONH4 | B.HOCH2CH2OH |
| C.HOCH2CH2NH2 | D.H2NOCCH2CH2CONH2 |
②已知电解质在水中的电离平衡常数(25℃)如下表:
| 弱电解质 |
H2CO3 |
NH3·H2O |
| 电离平衡常数 |
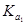 =4.30×10-7 =4.30×10-7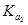 =5.60×10-117 =5.60×10-117 |
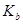 =5.60×10-117 =5.60×10-117 |
则常温下0.1mol·L-1的(NH4)2CO3溶液呈碱性的原因 。
Ⅰ.在甲溶液中通入过量CO2生成乙和另一种具有漂白性的物质,在乙溶液中滴加某钠盐溶液丙可以生成丁溶液(丁溶液呈中性),同时产生无色气体,已知题中所涉及的物质皆为中学化学中常见物质。回答下列问题:
(1)甲的化学式为 。
(2)写出乙在医疗上的一个用途 。
(3)在乙溶液中滴加丙溶液生成丁溶液的离子方程式 。
Ⅱ.固体化合物X由四种常见的短周期元素组成,可用作牙膏中的添加剂。现取39.3g化合物X进行如下实验: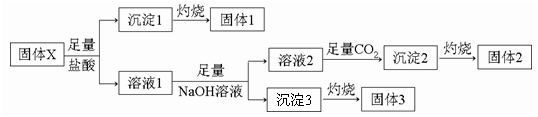
实验结束后得到15.3g固体2和6.0g固体3,且固体1、固体2、固体3都可用作耐高温材料。回答下列问题:
(1)NaOH的电子式为 ,沉淀2的化学式为 。
(2)固体X的化学式为 。
(3)溶液1中加入足量NaOH溶液,反应的化学方程式为 。
(4)在高温下,固体3中某元素的单质可以与固体1发生置换反应,请写出此反应的化学方程式 。
(5)设计一个实验方案,比较固体2和固体3中两不同元素对应单质的活动性强弱 。
【化学—选修5有机化学基础】某芳香烃A是有机合成中非常重要的原料,通过质谱法测得其最大质荷比为118;其核磁共振氢谱中有5个峰,峰面积之比为1:2:2:2:3;其苯环上只有一个取代基。以下是以A为原料合成高分子化合物F、I的路线图,试回答下列问题: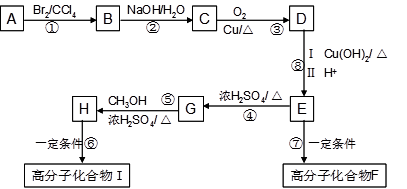
(1)A的结构简式为 。
(2)D中的官能团名称是 。
(3)I的结构简式为 。
(4)上述反应中属于取代反应的是 。
(5)反应⑥、⑦生成的高分子化合物的反应原理是否相同 。
(6)写出下列反应的化学方程式:
反应⑤ ;反应⑦ 。
(7)符合以下条件的D的同分异构体有 种(不考虑立体异构)。
| A.苯环上有两个取代基 | B.苯环上的一氯代物有两种 |
| C.加入三氯化铁溶液不显色 | D.能发生银镜反应 |
【化学—选修3物质结构与性质】前四周期原子序数依次增大的六种元素M、A、B、C、D、E中,M、A的最高化合物与最低化合价的绝对值相等,A形成的化合物种类最多,A、B属于同一短周期元素且相邻, C、D、E是位于同一周期的金属元素,基态C原子的价电子层中未成对电子为1个,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2。
(1)六种元素中第一电离能最小的是 (填元素符号,下同),其原子结构示意图是______。
(2)M与B元素形成的化合物空间构型是_____,在实验室制取该物质的方法是 (用化学反应方程式表示),收集方法是_______;
(3)E的价层电子排布图为 ,未成对的电子数是______;很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③ 、④HCHO。
、④HCHO。
其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质) 。
(4)金属C晶体的晶胞结构如图。C晶体晶胞中金属原子的配位数之比为 。在一个晶胞中含有C原子是_____个。氧化镍(NiO )是一种纳米材料,比表面积S(m2/g)是评价纳米材料的重要参数之一(纳米粒子按球形计)。已知氧化镍的密度为ρg/cm3;其纳米粒子的直径为Dnm列式表示其比表面积 m2/g。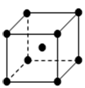
【化学—选修2化学与技术】实验室里用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备硫酸、聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),其过程如下:
请回答下列问题:
(1)过程①中,加快反应速率的方法有 。FeS和O2、H2SO4反应的化学方程式是____________。
(2)过程②中产生的气体可用于氧化产生硫酸,为使SO2尽快、尽多的转化为SO3,可采取的措施是_____(填字母)
A.高温、高压 B.适当温度、催化剂
C.通入过量的氧气 D.低温、低压
产生的尾气会对大气造成污染,可选用下列试剂中的_________吸收(填字母)。
A.浓H2SO4B.蒸馏水 C.NaOH溶液D.浓硝酸
(3)过程③中,需要加入的物质名称是_______。反应的离子方程式是________。
(4)过程④中的实验操作是__________________________。
(5)过程⑥中,将溶液Z加热到70~80℃,目的是__________________________。
(6)实验室为测定所得到的聚铁样品中铁元素的质量分数,进行下列实验:①用天平称取样品5.35g;②将样品溶于足量硝酸酸化后,再加入足量的氯化钡溶液;③过滤、洗涤、干燥,称量,得固体质量为6.99g。若该聚铁主要成分为[Fe(OH) SO4]n,则该聚铁中铁元素的质量分数为_____________(精确至0.01%)。