煤是重要的能源,也是生产化工产品的重要原料。试用所学知识,解答下列问题:
(1)煤的转化技术包括煤的气化技术和液化技术。煤的液化技术又分为 和 。
(2)在煤燃烧前需对煤进行脱硫处理。煤的某种脱硫技术的原理如下图所示:
这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为 ,
第二步反应的离子方程式为 。
(3)工业煤干馏得到的产品有焦炭、 、 等。
(4)湿式石灰石—石膏法脱硫工艺是烟气脱硫技术中最成熟的一种方法。其工艺流程是:烟气经锅炉预热器出来,进入电除尘器除掉大部分粉煤灰烟尘,再经过一个专门的热交换器,然后进入吸收塔,烟气中的SO2与含有石灰石的浆液进行气液接触,通入空气后生成石膏,经脱硫的烟气,应用循环气体加热器进行再加热,进入烟囱,排入大气。
①写出湿法石灰石—石膏法脱硫所涉及的化学反应方程式:__________________________________。
②用石灰石浆液作SO2吸收剂而不用熟石灰吸收SO2的原因是:______________________________。
③上述过程中得到的石膏,如果含氯化合物(主要来源于燃料煤)超过杂质极限值,则石膏产品性能变坏。工业上消除可溶性氯化物的方法是___________________________________________________。
(5)某化学兴趣小组为了测定烟气脱硫所得石膏的组成(CaSO4·xH2O)即测定x值,做如下实验:将石膏加热使之脱水,加热过程中固体的质量与时间的变化关系如图所示。数据表明当固体的质量为2.72g后不再改变。①石膏的化学式为_______________。②图像中AB段对应化合物的化学式为_________________。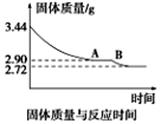
婴儿用的一次性纸尿片中有一层能吸水保水的物质。下列高分子中有可能被采用的是()




| A. | B.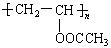 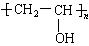 |
| C. | D. |
已知可逆反应:Fe(s) + CO2(g) FeO(s) + CO(g),其温度与平衡常数K的关系如下表:
FeO(s) + CO(g),其温度与平衡常数K的关系如下表:
| T(K) |
938 |
1173 |
| K |
1.47 |
2.15 |
(1)写出该反应的平衡常数表达式____________________。
(2)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,改变下列条件再达平衡后判断(选填“增大”、
“减小”、“不变”):
①升高温度,混合气体的平均相对分子质量_________;
②充入氦气,混合气体的密度__________。
(3)该反应的逆反应速率随时间变化情况如右图所示。
①从右图可知,在t1时改变了某种反应条件,反应在
t2时达到平衡,改变的条件可能是_______(选填编号)。
a.升高温度 b.增大CO2的浓度
c.减小CO2的浓度 d.使用催化剂
②如果在t3时增加CO2的量,t4时反应又处于新平衡状态,请在上图 画出t3~ t5时间段的v逆变化曲线。
画出t3~ t5时间段的v逆变化曲线。
③能作为判断该反应达到平衡状态的依据是(选填编号)。
a.v正(CO2)=v逆(CO)b.容器内气体总压强不再变化
c.容器内气体密度不再变化 d.使用催化剂后,正、逆反应速率同比例加快
近年来,我国储氢纳米碳管研究获得重大进展,电弧法合成的碳纳米管,常伴有大量的物质——碳纳米颗粒。这种碳纳米颗粒可用氧化气化法除去,同时生成的产物对环境不会产生污染。在整个反应体系中除了碳单质外,还有K2Cr2O7 、K2SO4、Cr2(SO4)3、H2SO4、H2O和X。
(1)根据题意,可判断出X是____________(写化学式)。
(2)在反应中,氧化剂应是____________(写化学式),硫酸的作用是_____________。
(3)写出并配平该反应的化学方程式,并标出电子转移的方向和数目。
(4)在上述反应中,若产生22 g X物质,则反应中转移的电子数目为_____________。
钠、镁、铝是重要的金属元素,与我们的生活和生产关系密切。
(1)元素的性质特别是化学性质取决于元素原子结构。钠离子的电子排布式为_______,铝元素的原子结构示意图为_________。
(2)钠、镁、铝元素的阳离子半径由小到大的顺序是_____________(用离子符号表示)。在短周期中非金属性最强的元素位于第____周期____族。
(3)钠、镁、铝的单质及其化合物在某些性质上存在着递变规律。下列有关说法正确的是___________(选填编号)。
a.三种元素的金属性越强,金属单质的熔点就越高
b.其碱性按NaOH、Mg(OH)2、Al(OH)3顺序依次减弱
c.常温下都能与浓硝酸剧烈反应生成硝酸盐,但剧烈程度依次减弱
d.等质量的钠、镁、铝与足量稀硫酸反应生成氢气的物质的量依次增加
(4)1932年,美国化学大师Linus Pauling提出电负性(用希腊字母χ表示)的概念,用来确定化合物中原子某种能力的相对大小。Linus Pauling假定氟元素的电负性为4,并通过热化学方法建立了其他元素的电负性。第三周期主族元素的电负性如下:
| 元素 |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
| 电负性 |
0.9 |
1.2 |
1.5 |
1.8 |
2.1 |
2.5 |
3.0 |
从上表可以看出电负性的大小与元素非金属性的强弱关系是____________________;大量事实表明,当两种元素的χ值相差大于或等于1.7时,形成的化合物一般是离子化合物,根据此经验规律,AlBr3中的化学键类型应该是。
工业上生产Na、Ca、Mg都用电解其熔融的氯化物,但钾却不能用电解熔融KCl的方法制得,因金属钾易溶于熔融态的KCl中而有危险,难获得钾,且降低电流效率。现生产钾是用属钠和熔化的KCl在一定的条件下反应制取:
有关数据如下表:
| 熔点℃ |
沸点℃ |
密度(g/cm3) |
|
| Na |
97.8 |
882.9 |
0.97 |
| K |
63.7 |
774 |
0.86 |
| NaCl |
801 |
1413 |
2.165 |
| KCl |
770 |
1500(升华) |
1.984 |
(1)工业上制取金属钾的化学原理是,在常压下金属钾转为气态从反应混合物中分离的最低温度约为,而反应的最高温度应低于。
(2)在制取金属钾的过程中,为了提高原料的转化率可采取的措施是。
(3)生产中常向反应物中通入一种气体,并将从反应器中导出的气体进行冷却得到金属钾,且将该气体可循环利用,该气体是________。
a.干燥的空气 b.氮气 c.二氧化碳 d.稀有气体
(4)常压下,当反应温度升高到900℃时,该反应的平衡常数可表示为K=。